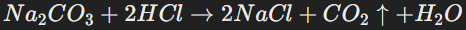Параграф 9 Химия 9 класс Габриелян | Конспект
Определение гидролиза
Гидролизом называют реакции обменного взаимодействия веществ с водой, приводящие к их разложению. Продуктами гидролиза являются соли, которые образуются при нейтрализации оснований кислотами. Гидролиз возможен, если соли содержат слабую кислоту или основание, а также определённые катионы и анионы. Например, гидролизу подвержены соли слабых кислот, такие как карбонаты. Уравнения гидролиза можно записывать в молекулярной и ионной формах.
Типы гидролиза
Сильное основание и слабая кислота:
Пример – карбонат натрия (Na₂CO₃), гидролиз которого сопровождается образованием гидроксид-ионов. Реакция:
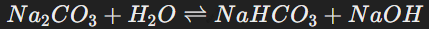
В растворе накапливаются OH⁻, вызывая щелочную реакцию среды.
pH больше 7.
Слабое основание и сильная кислота:
Пример – нитрат цинка (Zn(NO3)2). Процесс сопровождается накоплением H⁺:
Раствор приобретает кислую среду (pH < 7).
Условия протекания гидролиза
Для протекания гидролиза необходимы:
Слабая кислота или слабое основание в составе соли.
Вода, способная разлагать кристаллическую решётку соли на ионы.
Диссоциация соли в воде на катионы и анионы.
Реакция фенолфталеина
Фенолфталеин не меняет окраску в растворе хлорида натрия (NaCl), так как он является солью сильного основания и сильной кислоты. Такие растворы не подвержены гидролизу и имеют нейтральную среду. Примеры других подобных солей: KCl, Na₂SO₄.
Соли, неподверженные гидролизу
Соли сильных оснований и кислот, такие как NaCl, полностью диссоциируют в растворе. Они не вступают во взаимодействие с водой, так как их катионы и анионы не гидролизуются. Присутствие этих солей не меняет pH раствора.
Особенности гидролиза солей
В процессе гидролиза может образовываться осадок или выделяться газ, что подтверждается экспериментально.
Пример гидролиза с выделением газа: разложение карбоната натрия:
Пример осадка: реакция сульфатов бария:
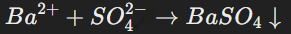
Гидролиз важен для понимания химических свойств растворов солей, влияния их состава на pH среды, а также для определения их реакций в растворе.