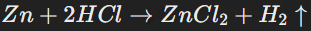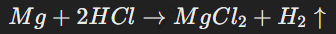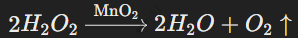Параграф 3 Химия 9 класс Габриелян | Конспект
Скорость химических реакций
Скорость химической реакции — это изменение концентрации реагентов или продуктов за единицу времени. Формула для её расчёта:
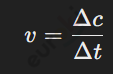
где Δc — изменение концентрации вещества, а Δt — время, за которое происходит это изменение.
Скорость реакции зависит от:
Природы реагентов (химическая активность веществ),
Концентрации веществ,
Температуры,
Площади соприкосновения реагентов,
Наличия катализатора.
Например:
Реакция цинка с соляной кислотой протекает быстрее:
Реакция с уксусной кислотой идёт медленнее из-за меньшей активности кислоты:
Эти различия подчёркивают важность влияния факторов на скорость химических процессов.
Факторы, влияющие на скорость реакции
1. Природа реагирующих веществ
-
Скорость химической реакции определяется химической активностью веществ. Например:
Активные металлы, такие как магний, реагируют с кислотами быстрее, чем менее активные (например, железо).
Соляная кислота реагирует быстрее с цинком, чем уксусная кислота, так как она является сильной кислотой.
Пример:
Эта реакция протекает быстрее, чем взаимодействие цинка с уксусной кислотой.
2. Температура
При повышении температуры молекулы реагентов получают больше энергии, что увеличивает вероятность их столкновений.
Например, нагревание раствора серной кислоты с металлической стальной скрепкой приводит к ускорению выделения водорода. Этот эффект связан с увеличением скорости движения молекул при высокой температуре.
3. Концентрация реагирующих веществ
Увеличение концентрации приводит к большему числу молекул в объёме, что повышает вероятность их столкновений.
Пример: в растворе тиосульфата натрия осадок появляется быстрее при увеличении концентрации реагента.
4. Площадь соприкосновения реагирующих веществ
-
Чем больше поверхность контакта реагентов, тем быстрее идёт реакция. Например:
Измельчённый мрамор реагирует с кислотой быстрее, чем цельный кусок.
Реакции гетерогенных систем (твердые и жидкие вещества) происходят только на границе фаз.
5. Наличие катализатора
Катализатор — вещество, которое ускоряет химическую реакцию, не расходуясь в процессе. Например:
-
Катализаторы позволяют проводить реакции при более низких температурах и давлениях, экономя энергию. Например:
Оксид марганца ускоряет разложение перекиси водорода на воду и кислород.
В промышленности катализаторы используются для ускорения синтеза аммиака, переработки нефти и других процессов.
Катализ
Катализ — это явление, при котором скорость химической реакции изменяется под действием катализатора. Катализаторы делятся на:
Гомогенные катализаторы — находятся в той же фазе, что и реагенты.
Гетерогенные катализаторы — находятся в другой фазе.
История катализа:
В 1811 году русский химик Константин Сигизмундович Кирхгоф изучал превращение крахмала в сахар под действием воды и открыл влияние катализатора.
В 1835 году шведский учёный Й. Берцелиус ввёл термины "катализ" и "катализатор".
Катализ широко применяется:
В промышленности: 90% всех химических процессов зависят от катализаторов (например, очистка выхлопных газов автомобилей).
В биологии: ферменты, которые являются органическими катализаторами, ускоряют реакции в клетках.
Пример фермента:
Каталаза разлагает перекись водорода: