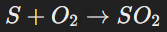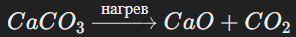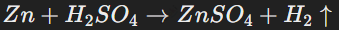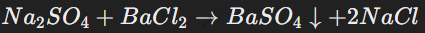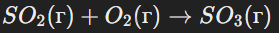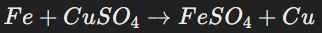Параграф 2 Химия 9 класс Габриелян | Конспект
Классификация химических реакций
Химические реакции — это взаимодействия веществ, приводящие к образованию новых соединений. Чтобы упростить их изучение и понимание, химические реакции классифицируют по различным признакам:
По числу и составу реагентов и продуктов,
По тепловому эффекту,
По агрегатному состоянию,
По обратимости,
По использованию катализатора,
По изменению степени окисления элементов.
Эти критерии позволяют упорядочить реакции и систематизировать знания о химических процессах.
Классификация химических реакций по числу и составу реагентов и образующихся веществ
-
Реакции соединения
Два или несколько веществ соединяются в одно сложное вещество. Пример:
-
Такие реакции могут происходить между:
Простыми веществами (например, металл + неметалл),
Простым и сложным веществом,
Двумя сложными веществами.
Пример более сложной реакции:

-
Реакции разложения
Одно сложное вещество распадается на два или более простых веществ. Пример:
-
Признаки реакции разложения:
Выделение газа,
Образование осадка,
Изменение цвета реагентов или продуктов.
-
Реакции замещения
Один элемент вытесняет другой из соединения. Пример:
Эта реакция демонстрирует активность металлов: более активный металл замещает менее активный в соединении. Также такие реакции можно наблюдать в реакциях неметаллов (например, хлор вытесняет йод из раствора йодида калия).
-
Реакции обмена
Два сложных вещества обмениваются своими составными частями. Пример:
Признак реакции обмена — образование осадка, газа или воды в результате взаимодействия реагентов.
Классификация химических реакций по тепловому эффекту
-
Экзотермические реакции
В таких реакциях выделяется тепло. Пример: горение:
Тепло ощущается как нагревание окружающей среды.
-
Эндотермические реакции
Реакции, в которых поглощается тепло. Пример:
Эти реакции требуют внешнего источника энергии (например, нагревания).
Тепловой эффект обозначается буквой Q: если Q>0, реакция экзотермическая; если Q<0, реакция эндотермическая. Термические уравнения показывают, сколько тепла выделяется или поглощается.
Классификация химических реакций по агрегатному состоянию реагентов и продуктов реакции
-
Гомогенные реакции
Все реагенты и продукты находятся в одной фазе (газ, жидкость или твёрдое вещество). Пример:
-
Гетерогенные реакции
Реагенты находятся в разных фазах. Например, взаимодействие твёрдого пирита и газа:
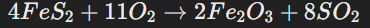
Фазовые изменения играют важную роль в промышленных процессах и в природе, таких как образование минералов или сжигание угля.
Классификация химических реакций по обратимости
-
Необратимые реакции
Протекают только в одном направлении, продукты реакции не могут вернуться в исходное состояние. Пример:
-
Обратимые реакции
Протекают в двух направлениях при определённых условиях, достигая химического равновесия. Пример:
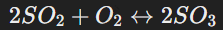
Химическое равновесие в обратимых реакциях можно смещать изменением температуры, давления или концентрации веществ.
Классификация химических реакций по использованию катализатора
Катализаторы ускоряют химические реакции, не расходуясь в процессе. Пример:
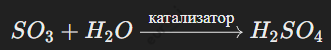
Катализаторы бывают:
Гомогенными (находятся в той же фазе, что и реагенты),
Гетерогенными (находятся в другой фазе).
Классификация химических реакций по изменению степени окисления элементов
-
Окислительно-восстановительные реакции (ОВР)
Включают изменения степени окисления элементов. Пример:
-
В ОВР происходит передача электронов:
Окисление — отдача электронов,
Восстановление — принятие электронов.
ОВР имеют большое значение в энергетике, металлургии и биологических процессах.