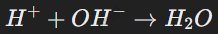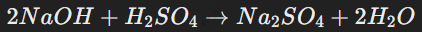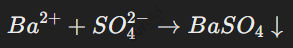Параграф 6 Химия 9 класс Габриелян | Конспект
Химические свойства кислот как электролитов
-
Кислоты обладают кислым вкусом:
Все кислоты имеют кислый вкус, однако в лаборатории проверка на вкус запрещена по технике безопасности. Кислотный вкус обусловлен присутствием ионов H+ (катионов водорода).
Например, кислый вкус характерен для пищевых кислот: лимонной, яблочной, аскорбиновой.
-
Кислоты изменяют окраску индикаторов:
Лакмус, универсальный индикатор, метилоранж окрашиваются в красный цвет в присутствии кислоты.
Фенолфталеин в кислой среде остается бесцветным.
-
Реакция кислот с основаниями (нейтрализация):
Кислоты взаимодействуют с основаниями с образованием соли и воды:
Эта реакция — частный случай обменных реакций. Пример:
-
Уравнения реакции можно записать в виде:
Молекулярного: полное описание веществ.
Ионного: с учетом распада сильных электролитов на ионы.
-
Реакция кислот с оксидами металлов:
Кислоты взаимодействуют с оксидами металлов с образованием соли и воды. Пример:
Реакция подтверждается изменением цвета раствора и выделением газа (в зависимости от реактивов).
-
Кислоты взаимодействуют с металлами:
Сильные кислоты, такие как серная и соляная, реагируют с металлами, стоящими в ряду напряжений до водорода, с выделением газа H2:
В этом случае ионы H+ восстанавливаются до молекулярного водорода.
-
Правило Бертолле:
Реакция между растворами электролитов возможна, если в результате образуется осадок, газ или слабый электролит (например, вода).
-
Реакции с выделением газа:
Пример:
В процессе реакции происходит разложение анионов кислоты на газообразные продукты.
-
Реакции с выпадением осадка:
Использование таблицы растворимости помогает предсказать образование осадков. Например:
-
Ионные уравнения:
Уравнения реакций в растворах записываются в сокращённой форме, где участвуют только ионы, непосредственно взаимодействующие друг с другом.