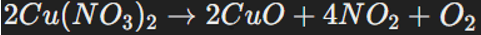Параграф 18 Химия 9 класс Габриелян | Конспект
Оксиды азота
Азот образует пять основных оксидов:
Оксид азота(I) (N2O) — бесцветный газ со сладковатым запахом, известный как «веселящий газ». Образуется при разложении нитрата аммония (NH4NO3→N2O+2H2O).
Оксид азота(II) (NO) — бесцветный газ, который быстро окисляется на воздухе с образованием бурого газа: 2NO+O2→2NO2.
Оксид азота(III) (N2O3) — жидкость синего цвета, существует только при низких температурах.
Оксид азота(IV) (NO2) — бурый газ с характерным запахом, токсичен и ядовит, легко превращается в димер (N2O4) при низких температурах.
Оксид азота(V) (N2O5) — бесцветное твердое вещество, нестабильное, разлагающееся на кислород и оксид азота(IV): 2N2O5→4NO2+O2.
Эти оксиды обладают кислотными свойствами и образуют кислоты при взаимодействии с водой. Например: NO2+H2O→HNO3+HNO2.
Азотистая кислота (HNO2)
Азотистая кислота является слабым электролитом и существует только в разбавленных растворах. Она легко разлагается на оксид азота(II) и азотную кислоту: 3HNO2→HNO3+2NO+H2O
Азотистая кислота обладает двойственными свойствами:
Восстановительные свойства: Например, в реакции с йодной кислотой: 2HNO2+2HI→2NO+I2+2H2O
Окислительные свойства: Например, с сероводородом: HNO2+H2S→NO+S+H2O
Соли азотистой кислоты называются нитритами  , они хорошо растворимы в воде и проявляют окислительно-восстановительные свойства. Например, нитрит аммония разлагается на азот и воду:
, они хорошо растворимы в воде и проявляют окислительно-восстановительные свойства. Например, нитрит аммония разлагается на азот и воду:
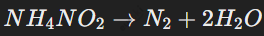
Азотная кислота (HNO3)
Азотная кислота — сильный электролит, который в воде полностью диссоциирует:
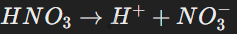
Она обладает ярко выраженными окислительными свойствами:
Реакция с медью:
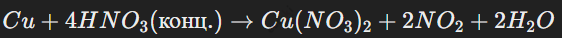
Реакция с неметаллами, например с серой:

В разбавленном виде азотная кислота также окисляет металлы:

Соли азотной кислоты (нитраты)
Нитраты  — белые кристаллические вещества, хорошо растворимые в воде. При нагревании нитраты разлагаются в зависимости от активности металла:
— белые кристаллические вещества, хорошо растворимые в воде. При нагревании нитраты разлагаются в зависимости от активности металла:
Для щелочных металлов:

Для менее активных металлов, таких как медь:
Эти реакции используются в лабораторной практике для получения кислорода и изучения термической устойчивости солей.
Применение азотной кислоты и нитратов
Азотная кислота используется:
В производстве удобрений (например, аммиачной селитры NH
4NO3).В изготовлении взрывчатых веществ, таких как тротил.
Для получения красителей и лекарственных препаратов.
В металлургии для травления металлов.
Нитраты применяются как компоненты порохов и в сельском хозяйстве для обогащения почвы азотом, что способствует повышению урожайности.