Параграф 17 Химия 9 класс Габриелян | Конспект
Свойства аммиака
Аммиак (NH3) — бесцветный газ с резким запахом, который легче воздуха (относительная плотность аммиака по воздуху — 0.59). Он хорошо растворяется в воде, образуя слабощелочной раствор, известный как аммиачная вода или гидрат аммиака (NH3⋅H2O). При растворении аммиак частично диссоциирует:
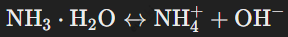
Гидрат аммиака проявляет слабые щелочные свойства, так как концентрация гидроксид-ионов (OH−) невелика. Аммиак способен участвовать в окислительно-восстановительных реакциях, проявляя восстановительные свойства. Например, при взаимодействии с оксидами металлов:
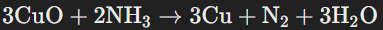
Это восстановительная реакция, в которой медь восстанавливается из оксида меди(II).
Химические свойства аммиака
Аммиак активно вступает в реакции с кислотами, образуя соли аммония. Например:
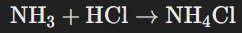
Катион аммония  формируется за счёт донорно-акцепторного механизма. В этом процессе атом азота аммиака передаёт неподелённую электронную пару атому водорода. Связь между атомами азота и водорода называют донорно-акцепторной.
формируется за счёт донорно-акцепторного механизма. В этом процессе атом азота аммиака передаёт неподелённую электронную пару атому водорода. Связь между атомами азота и водорода называют донорно-акцепторной.
Аммиак также вступает в реакции окисления, особенно при нагревании. Например, при каталитическом окислении аммиака на платине он превращается в оксиды азота:

Этот процесс используется в промышленности для получения азотной кислоты.
Применение аммиака
Аммиак является важным химическим продуктом, широко применяемым в различных областях.
В производстве удобрений: используют для синтеза аммонийных солей, таких как нитрат аммония (NH4NO3) и сульфат аммония ((NH4)2SO4).
В промышленности: аммиак применяют в процессе производства азотной кислоты.
В холодильных установках: жидкий аммиак используется как хладагент благодаря его способности легко испаряться и поглощать тепло.
В медицине: раствор аммиака (нашатырный спирт) применяют для стимуляции дыхания.
Соли аммония
Соли аммония представляют собой соединения, содержащие ион аммония  . Примеры:
. Примеры:
Хлорид аммония (NH4Cl):
Это белое кристаллическое вещество, хорошо растворимое в воде. При нагревании разлагается:

Нитрат аммония (NH4NO3):
Используется как компонент взрывчатых веществ и удобрений.
Соли аммония играют важную роль в химической промышленности. Их применяют для производства красителей, синтетических волокон и чистящих средств.
Механизм взаимодействия аммиака
Механизм взаимодействия аммиака с кислотами основан на образовании донорно-акцепторной связи. Аммиак передаёт неподелённую электронную пару атому водорода, а образующийся катион аммония  становится устойчивым благодаря электростатическим силам.
становится устойчивым благодаря электростатическим силам.


