Параграф 16 Химия 9 класс Габриелян | Конспект
Характеристика атомов элементов VA-группы
VA-группа периодической системы включает шесть элементов: азот (N), фосфор (P), мышьяк (As), сурьму (Sb), висмут (Bi) и москвавий (Mc). Эти элементы объединяет наличие пяти валентных электронов на внешнем энергетическом уровне.
На внешнем уровне два электрона занимают s-подуровень, а три — p-подуровень. Это позволяет им образовывать как ковалентные связи, так и принимать три электрона, проявляя окислительные свойства.
С ростом радиуса атома элементы группы теряют неметаллические свойства, переходя от неметаллов (азот, фосфор) к полуметаллам (мышьяк, сурьма) и металлам (висмут).
Азот отличается высокой электроотрицательностью (3.04), уступая только фтору (3.98) и кислороду (3.44). Это объясняет его способность вступать в сильные химические связи.
Молекула азота (N₂) состоит из двух атомов, связанных тройной ковалентной связью, которая обеспечивает ей высокую прочность и химическую инертность.
Азот в природе
Азот составляет 78% объема земной атмосферы, где находится в виде двухатомного газа (N₂), характеризующегося низкой реакционной способностью.
В земной коре азот встречается в виде соединений, например, нитратов натрия (NaNO3) и калия (KNO3). Эти минералы широко распространены и используются для производства удобрений.
Азот играет важную биологическую роль, входя в состав белков, аминокислот, нуклеиновых кислот и других жизненно важных молекул.
В круговороте азота важное место занимают азотфиксирующие бактерии, которые преобразуют атмосферный азот в соединения, доступные для растений. Например, бобовые растения фиксируют азот благодаря симбиозу с бактериями рода Rhizobium.
Азот необходим для синтеза аммиака (NH3), используемого в сельском хозяйстве для производства удобрений.
Химическая связь в молекуле азота
Связь в молекуле азота (N₂) — тройная ковалентная. Каждый атом азота образует три общие электронные пары:
Тройная связь делает молекулу азота чрезвычайно прочной, обеспечивая высокую энергию связи (941 кДж/моль) и низкую реакционную способность при обычных условиях.
Эта прочная связь преодолевается только при высоких температурах, например, при взаимодействии с металлами или водородом.
Химические свойства азота
Реакция с металлами (образование нитридов): При нагревании азот взаимодействует с активными металлами, образуя нитриды, например:

Нитриды — это соединения, в которых азот проявляет степень окисления −3.
Реакция с водородом (образование аммиака): Азот окисляется при реакции с водородом под действием катализаторов при высоких температуре и давлении:
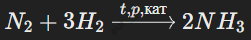
Аммиак (NH3) используется в производстве удобрений, взрывчатых веществ и других соединений.
Восстановительные свойства азота: Азот может проявлять восстановительные свойства в условиях электрической дуги, реагируя с кислородом:
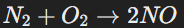
Окись азота (NO) — важный компонент для синтеза азотной кислоты (HNO3).
Применение азота
Азот используется в промышленности для создания инертной атмосферы в процессе производства синтетических волокон, чистых металлов и сплавов. Благодаря своей химической инертности, он предотвращает нежелательные реакции.
Жидкий азот (−196∘C) применяется в медицине для криохирургии, заморозки тканей и органов, а также для хранения биологических материалов.
В пищевой промышленности жидкий азот используется для замораживания и хранения продуктов, а также для упаковки, предотвращающей окисление.
Природные соединения азота (например, селитры) широко применяются для производства взрывчатых веществ, ракетного топлива и азотных удобрений.
Азот входит в состав многих синтетических продуктов, включая полиамиды и нейлон, используемых в текстильной промышленности.



