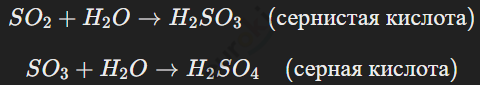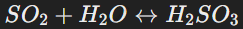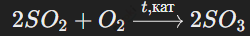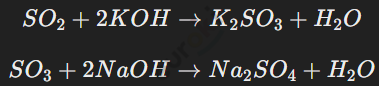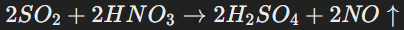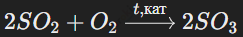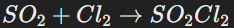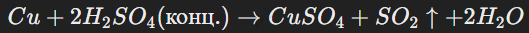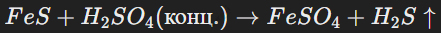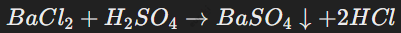Параграф 15 Химия 9 класс Габриелян | Конспект
Основные степени окисления серы
Сера проявляет степени окисления +4 и +6 в соединениях с кислородом. К основным относятся диоксид серы (SO2) и триоксид серы (SO3).
Диоксид серы (SO2) представляет собой бесцветный газ с характерным резким запахом. Этот газ часто встречается в атмосфере из-за выбросов при вулканической активности и горении серосодержащих веществ.
Триоксид серы (SO3) — это твердое вещество, которое легко реагирует с водой, образуя серную кислоту (H2SO4).
Эти оксиды имеют кислотный характер, образуя при реакции с водой кислоты:
Оксиды серы: свойства и получение
Диоксид серы (SO2) можно получить в лаборатории реакцией обмена между сульфитами металлов и сильными кислотами:
Диоксид серы хорошо растворяется в воде, образуя слабую сернистую кислоту:
Эта кислота является нестабильной и разлагается при нагревании.
Триоксид серы (SO3) можно получить путем каталитического окисления диоксида серы кислородом воздуха:
Оксиды серы (SO2 и SO3) активно реагируют с основаниями, образуя соли — сульфиты и сульфаты:
Окислительные свойства соединений серы
Диоксид серы (SO2) выступает в качестве восстановителя, активно взаимодействуя с сильными окислителями, например, нитратной кислотой:
В реакциях с кислородом диоксид серы окисляется до триоксида серы:
Восстановительные свойства соединений серы
Диоксид серы (SO2) в реакциях с хлором проявляет восстановительные свойства, образуя дихлоридоксид серы:
Серная кислота (H2SO4) может быть как окислителем, так и восстановителем в зависимости от условий реакции. Например:
Кислородсодержащие кислоты серы
Сернистая кислота (H2SO3) — слабая кислота, которая существует только в водных растворах. Она проявляет сильные восстановительные свойства.
Серная кислота (H2SO4) — одна из сильнейших кислот, обладает ярко выраженными окислительными свойствами. Концентрированная кислота реагирует с металлами, оксидами и сульфидами, например:
Соли серной кислоты — сульфаты (
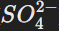 ) широко применяются в промышленности. Например:
) широко применяются в промышленности. Например:
Применение соединений серы
Диоксид серы используется в виноделии как консервант, а также для отбеливания тканей и бумаги.
Серная кислота необходима в производстве удобрений, красителей, пластмасс и аккумуляторов.
Сульфаты, такие как сульфат бария (BaSO4), применяются в медицине для рентгенологических исследований.