Параграф 12 Химия 9 класс Габриелян | Конспект
Получение галогеноводородов
Галогеноводороды можно получить различными методами, включая реакцию хлоридов с концентрированной серной кислотой, что приводит к выделению газообразного хлороводорода.
Йодоводород и бромоводород получают с использованием кислот-окислителей, таких как фосфорная кислота, которая позволяет избежать побочных реакций.
Полученные газы характеризуются высокой летучестью и сильным запахом.
Примеры реакций:
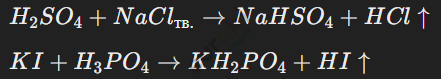
Химические свойства галогеноводородов
Галогеноводороды проявляют кислотные свойства благодаря способности диссоциировать в воде с образованием H+ и анионов галогенов.
По мере увеличения радиуса атома галогена сила кислот увеличивается: HF < HCl < HBr < HI.
Они взаимодействуют с различными соединениями, включая оксиды, с образованием солей, например, с силикатами.
Пример реакции:
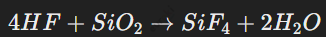
Соли галогеноводородных кислот
Большинство солей галогеноводородных кислот растворимы в воде, но существуют исключения, например, AgCl, образующий белый осадок.
Соли различаются по цвету: AgCl — белый осадок, AgBr — светло-жёлтый, AgI — жёлтый.
Эти реакции позволяют использовать соли для качественного анализа анионов, особенно в аналитической химии.
Пример реакции:

Применение галогеноводородных соединений
Галогеноводороды широко применяются в промышленности, например, для травления стекла (плавиковая кислота) или обработки металлов.
Соляная кислота используется в синтезе хлоридов металлов, при производстве красителей, пластмасс и лекарственных препаратов.
Также галогеноводороды находят применение в очистке поверхностей и создании специальных материалов.


