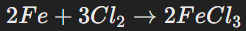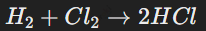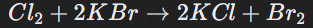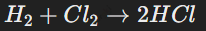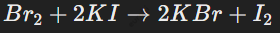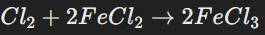Параграф 11 Химия 9 класс Габриелян | Конспект
Строение атомов
Элементы группы галогенов (фтор, хлор, бром, йод, астат, теннессин) принадлежат VIIА-группе Периодической системы химических элементов. Они имеют 7 электронов на внешнем энергетическом уровне.
Атомы галогенов стремятся принять один электрон, чтобы завершить внешний электронный слой до устойчивой конфигурации.
Увеличение радиуса атома от фтора к астату приводит к снижению электроотрицательности и ослаблению окислительных свойств.
Максимальная степень окисления галогенов равна +7, что достигается при взаимодействии с сильными окислителями, например с кислородом.
Природные соединения галогенов чаще всего встречаются в виде солей, таких как NaCl, KBr, CaCl₂, которые добываются из минералов или морской воды.
Некоторые галогены в обычных условиях находятся в виде газов (фтор и хлор), жидкостей (бром) или твёрдых веществ (йод, астат).
Химические свойства галогенов
Галогены проявляют сильные окислительные свойства, легко принимая электроны от других элементов.
Они активно взаимодействуют с металлами с образованием солей, например:
Взаимодействие с водородом приводит к образованию галогеноводородов — сильных кислот в водных растворах:
Галогены вытесняют менее активные элементы из их соединений, например:
Фтор — наиболее реакционноспособный элемент, способный реагировать даже с водой:
Взаимодействие галогенов с водородом
Реакция с водородом протекает с образованием галогеноводородов. Например:
Для йода реакция возможна только при нагревании, поскольку йод является менее активным по сравнению с хлором и фтором.
Галогеноводороды образуют сильные кислоты в водных растворах, за исключением HF, который имеет умеренную силу.
Окислительные свойства галогенов
Галогены способны окислять металлы и другие элементы до соединений с высшей степенью окисления.
Например, бром вытесняет йод из раствора йодида калия:
В водной среде хлор окисляет соединения, например, железо(II):
Биологическая роль и применение галогенов
Галогены жизненно важны для живых организмов. Например, фтор участвует в формировании зубной эмали, повышая её прочность.
Хлор применяют для обеззараживания воды, что предотвращает распространение инфекций.
Йод необходим для нормальной работы щитовидной железы. Йодная настойка используется для дезинфекции ран.
Бром применяют в медицине как успокаивающее средство и для производства противоэпилептических препаратов.
Галогены широко используются в промышленности: хлор для отбеливания тканей, синтеза пластмасс и получения растворителей, а фтор для создания фторополимеров (например, тефлона).
Промышленное использование галогенов
Галогены применяются в химической промышленности для синтеза соединений, таких как хлорид натрия (NaCl) и поливинилхлорид (ПВХ).
Хлор используется в сельском хозяйстве для защиты растений от вредителей.
Йод применяют в фармацевтике и для производства радиопрепаратов.
Фтор — ключевой элемент в производстве зубной пасты, а также в ядерной энергетике.
На основе галогенов разрабатываются синтетические волокна, пластики и бытовая химия.