Решебник по химии 9 класс Габриелян | Страница 71
Страница 71
Проверьте свои знания
1. Как получают галогеноводороды в промышленности и лаборатории? Как изменяется скорость реакции синтеза галогеноводородов в зависимости от природы галогена?
Галогеноводороды — это летучие водородные соединения галогенов. В промышленности важнейший из них — хлороводород — получают прямым синтезом из хлора и водорода:
(H₂ + Cl₂ → 2HCl).
В лаборатории галогеноводороды получают взаимодействием твёрдых галогенидов с концентрированными кислотами. Например:
(H₂SO₄(конц.) + NaCl(тв.) → NaHSO₄ + HCl↑).
Скорость синтеза галогеноводородов напрямую зависит от прочности связи между атомами в молекуле. В ряду HF — HCl — HBr — HI длина связи увеличивается, а прочность уменьшается. Следовательно, скорость синтеза растёт в том же порядке: HF < HCl < HBr < HI.
2. Каков состав высших оксидов галогенов и какими свойствами они обладают? Можно ли получить эти оксиды из простых веществ синтезом?
Высшие оксиды галогенов, например, хлор(VII) — Cl₂O₇, бром(V) — Br₂O₅ и йод(VII) — I₂O₇, содержат галоген в высшей степени окисления. Эти соединения являются кислотными оксидами, они взаимодействуют с водой, образуя соответствующие кислоты. Например:
(Cl₂O₇ + H₂O → 2HClO₄).
Из-за высокой активности галогенов, особенно в высоких степенях окисления, такие оксиды не получают прямым синтезом из простых веществ. Они образуются в результате сложных многостадийных реакций, часто с применением окислителей.
3. С помощью какого реактива можно распознать галогенид-ион? Какой ион является исключением? Как его распознают?
Для качественного распознавания галогенид-ионов (Cl⁻, Br⁻, I⁻) используют раствор нитрата серебра (AgNO₃). При добавлении его к раствору соли с галогенид-ионом образуется осадок соответствующего галогенида серебра:
(Ag⁺ + Cl⁻ → AgCl↓ — белый осадок),
(Ag⁺ + Br⁻ → AgBr↓ — светло-жёлтый осадок),
(Ag⁺ + I⁻ → AgI↓ — жёлтый осадок).
Фторид-ион (F⁻) является исключением. Он не образует осадка с ионами серебра, так как фторид серебра растворим в воде. Его распознают по другим реакциям, например, осаждением фторидов кальция:
(Ca²⁺ + 2F⁻ → CaF₂↓ — белый осадок).
Стр. 71
Примените свои знания
4. Составьте схему образования химической связи для молекул галогеноводородов. Как меняется полярность связи и прочность молекул галогеноводородов от HF к HI?
Молекулы галогеноводородов (HF, HCl, HBr, HI) состоят из атома водорода и атома галогена, между которыми образуется ковалентная полярная связь. Эта связь образуется за счёт перекрывания орбиталей атома водорода (1s¹) и соответствующей валентной орбитали атома галогена (например, 2p у F).
Схема на примере HF:
H (1s¹) + F (2p⁵) → H–F (ковалентная полярная связь)
Общий электронный облак смещён к фтору, так как он более электроотрицателен.
Полярность связи от HF к HI уменьшается, так как электроотрицательность галогена убывает в ряду:
F > Cl > Br > I.
Прочность связи также убывает от HF к HI, так как увеличивается длина связи (радиус атома галогена растёт), и связь становится менее прочной.
5. Дайте сравнительную характеристику галогеноводородных кислот. Укажите черты сходства и различия. Сравнение химических свойств проиллюстрируйте уравнениями химических реакций в молекулярной и ионной формах.
Сходства галогеноводородных кислот (HF, HCl, HBr, HI):
Все являются кислотами, диссоциирующими в воде с образованием ионов H⁺ и соответствующих галогенид-ионов.
Обладают способностью реагировать с основаниями, солями и металлами.
Различия:
Сила кислот увеличивается от HF к HI: HF — слабая кислота, остальные — сильные.
Степень диссоциации в воде: HF частично диссоциирует, HCl, HBr, HI — полностью.
Окислительно-восстановительные свойства различны: например, HI легко окисляется.
Уравнения:
1. Реакция с основанием:
Молекулярное: (HCl + NaOH → NaCl + H₂O)
Ионное: (H⁺ + OH⁻ → H₂O)
2. Реакция с металлом (цинком):
Молекулярное: (Zn + 2HBr → ZnBr₂ + H₂↑)
Ионное: (Zn + 2H⁺ → Zn²⁺ + H₂↑)
6. В четырёх пробирках без этикеток находятся растворы фторида, хлорида, бромида и иодида натрия. Как с помощью одного реактива распознать эти вещества? Напишите уравнения соответствующих реакций.
Для распознавания галогенид-ионов используют раствор нитрата серебра (AgNO₃), с которым галогениды образуют осадки разного цвета.
Уравнения реакций:
(AgNO₃ + NaF → нет осадка) — фторид-ион не даёт осадка
(AgNO₃ + NaCl → AgCl↓ + NaNO₃) — белый осадок
(AgNO₃ + NaBr → AgBr↓ + NaNO₃) — светло-жёлтый осадок
(AgNO₃ + NaI → AgI↓ + NaNO₃) — жёлтый осадок
Вывод:
Пробирка без осадка — NaF
Белый осадок — NaCl
Светло-жёлтый — NaBr
Ярко-жёлтый — NaI
7. Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим превращениям:
а) Fe₂(SO₄)₃ + KI → FeSO₄ + I₂ + K₂SO₄
б) NaBr + Cl₂ → NaCl + Br₂
в) KBr + KMnO₄ + H₂SO₄ → Br₂ + K₂SO₄ + MnSO₄ + H₂O
Укажите окислители и восстановители.
а) Fe₂(SO₄)₃ + KI → FeSO₄ + I₂ + K₂SO₄
Определим степени окисления: Fe³⁺ → Fe²⁺ (восстановление)
I⁻ → I₂ (окисление)
Электронный баланс:
Fe³⁺ + 1e⁻ → Fe²⁺
2I⁻ → I₂ + 2e⁻
На 2Fe³⁺ нужно 2e⁻ → берём 2Fe³⁺ и 2I₂
Коэффициенты:
2Fe₂(SO₄)₃ + 6KI → 4FeSO₄ + 3I₂ + 3K₂SO₄
б) NaBr + Cl₂ → NaCl + Br₂
Электронный баланс: Br⁻ → Br₂ (окисление)
Cl₂ → Cl⁻ (восстановление)
Уравнение:
2NaBr + Cl₂ → 2NaCl + Br₂
в) KBr + KMnO₄ + H₂SO₄ → Br₂ + K₂SO₄ + MnSO₄ + H₂O
Степени окисления:
Br⁻ → Br₂ (окисление)
Mn⁷⁺ → Mn²⁺ (восстановление)
Баланс:
2Br⁻ → Br₂ + 2e⁻
Mn⁷⁺ + 5e⁻ → Mn²⁺
Наименьшее общее кратное — 10
Уравниваем:
5Br₂ + 2Mn
Уравнение: 10KBr + 2KMnO₄ + 8H₂SO₄ → 5Br₂ + 2MnSO₄ + 6K₂SO₄ + 8H₂O
Окислители и восстановители:
В а):
Окислитель — Fe³⁺ (в Fe₂(SO₄)₃),
Восстановитель — I⁻ (в KI)
В б):
Окислитель — Cl₂,
Восстановитель — Br⁻ (в NaBr)
В в):
Окислитель — Mn⁷⁺ (в KMnO₄),
Восстановитель — Br⁻ (в KBr)
8. При обработке 5,30 г смеси хлорида натрия и карбоната натрия избытком соляной кислоты выделилось 784 мл газа (н. у.). Рассчитайте массовые доли компонентов в смеси.
В данной задаче происходит взаимодействие двух веществ с соляной кислотой:
(NaCl + HCl → не выделяется газ)
(Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂↑) — здесь выделяется газ (CO₂).
Рассчитаем количество вещества CO₂:
(n = V / Vm = 0,784 л / 22,4 л/моль = 0,035 моль)
Из уравнения видно, что на 1 моль CO₂ приходится 1 моль Na₂CO₃.
Значит, (n(Na₂CO₃) = 0,035 моль)
Найдём массу Na₂CO₃:
(m = n × M = 0,035 × 106 = 3,71 г)
Масса смеси — 5,30 г
Тогда масса NaCl: (5,30 − 3,71 = 1,59 г)
Найдём массовые доли:
ω(Na₂CO₃) = 3,71 / 5,30 ≈ 0,70 или 70%
ω(NaCl) = 1,59 / 5,30 ≈ 0,30 или 30%
Ответ: массовая доля карбоната натрия — 70%, хлорида натрия — 30%.
9. Молярная масса бромида одновалентного металла на 31% больше, чем молярная масса хлорида этого металла. Что это за металл?
Пусть молярная масса металла — M.
Тогда:
Молярная масса хлорида металла: (M + 35,5)
Молярная масса бромида металла: (M + 80)
Согласно условию:
(M + 80) = 1,31 × (M + 35,5)
Раскроем скобки:
M + 80 = 1,31M + 46,505
80 − 46,505 = 1,31M − M
33,495 = 0,31M
M ≈ 108 г/моль
Это металл с молярной массой около 108 г/моль — серебро (Ag).
Ответ: серебро.
Стр. 71
Используйте дополнительную информацию
10. Объём производства соляной кислоты в России составляет 1 млн т в год. Сравните эти данные с объёмом производства соляной кислоты в трёх-четырёх других странах. Результат представьте в виде диаграммы в координатах: объём производства (млн т) — страна.
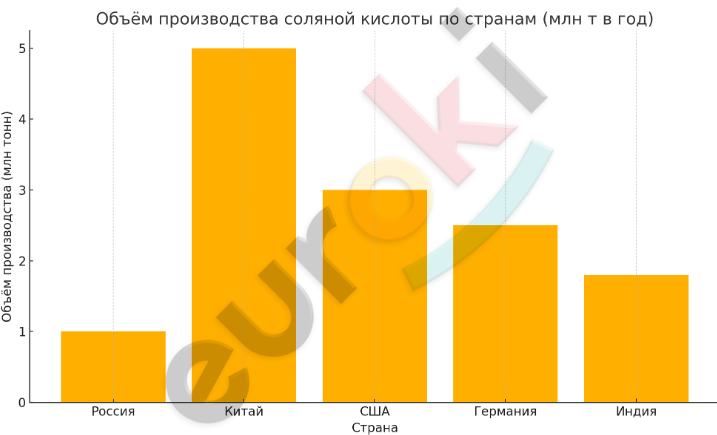
Вот диаграмма, иллюстрирующая объём производства соляной кислоты в России (1 млн т в год) по сравнению с другими странами:
Китай — 5 млн т
США — 3 млн т
Германия — 2,5 млн т
Индия — 1,8 млн т
Россия — 1 млн т
На диаграмме видно, что Россия заметно уступает Китаю и США по объёму производства.
11. Подготовьте сообщение об областях применения одного из следующих веществ: а) хлорида калия; б) фторида натрия; в) бромида калия; г) хлорида кальция.
Сообщение
Применение хлорида калия
Хлорид калия (KCl) — важнейшее неорганическое соединение, находящее широкое применение в различных отраслях. Наиболее масштабная область его использования — сельское хозяйство. Здесь он выступает в роли калийного удобрения, одного из трёх основных элементов питания растений (вместе с азотом и фосфором). Калий способствует формированию устойчивых к болезням и засухе растений, повышает урожайность и улучшает вкусовые качества продукции. KCl является составной частью комплексных удобрений и применяется в сельском хозяйстве в огромных количествах по всему миру.
Кроме того, хлорид калия используется в химической промышленности для получения металлического калия и в качестве сырья при производстве других калийных солей. В медицинской практике его применяют в виде растворов для восполнения дефицита калия в организме, так как этот элемент необходим для нормального функционирования сердца и мышц. Также KCl включается в состав некоторых лекарств, внутривенных растворов и биологических добавок.
В промышленности KCl используется при производстве стекла, моющих средств, при гальванических процессах и в качестве флюса при пайке и сварке. В пищевой промышленности он применяется как заменитель поваренной соли в диетических продуктах, особенно для людей с ограничением потребления натрия.
Таким образом, хлорид калия — это не только удобрение, но и ценное вещество с множеством технических и медицинских применений.
Сообщение
Применение фторида натрия
Фторид натрия (NaF) представляет собой важное соединение, которое широко применяется в медицине, химической промышленности и коммунальном хозяйстве. Одной из самых известных и распространённых областей его использования является профилактика кариеса. Фторид натрия входит в состав зубных паст, ополаскивателей и лечебных гелей, укрепляя эмаль зубов и снижая риск разрушения тканей. Также его используют в программах фторирования питьевой воды для улучшения стоматологического здоровья населения.
В металлургии NaF применяют в качестве флюса при пайке и сварке алюминия и его сплавов, где он помогает удалять оксидные плёнки и способствует качественному соединению деталей. В химической промышленности фторид натрия используется для синтеза других фторсодержащих соединений, в том числе фтористоводородной кислоты, а также в качестве катализатора и осушителя.
Фторид натрия также применяют для борьбы с насекомыми и грызунами, особенно в прошлом — как компонент инсектицидов и родентицидов. Однако в современных условиях его применение в этой области ограничено из-за токсичности и риска для окружающей среды.
Также NaF применяется в стекольной промышленности и при производстве эмалей, глазурей, специальных сортов стекла. Его способность изменять свойства расплава делает его ценным компонентом в технологии стеклоделия.
Таким образом, фторид натрия — это соединение с важным значением как в медицинской профилактике, так и в промышленности.
Сообщение
Применение бромида калия
Бромид калия (KBr) — бесцветное кристаллическое вещество с широким спектром применения, особенно в медицине, аналитической химии и фототехнике. В прошлом он широко использовался в медицине как седативное и противосудорожное средство. Его назначали при эпилепсии, повышенной возбудимости и бессоннице. Хотя сегодня бромид калия утратил своё значение в фармакологии в большинстве стран из-за появления более эффективных и безопасных препаратов, он всё ещё используется в ветеринарии, в частности, при лечении эпилепсии у собак.
В аналитической химии KBr используется для подготовки проб в инфракрасной спектроскопии (ИК-спектроскопии). Его высокая прозрачность в инфракрасной области делает его идеальным материалом для изготовления кювет и таблеток, в которые впрессовывают образцы для исследования. Это применение остаётся актуальным и важным в научных исследованиях и химическом анализе.
Кроме того, бромид калия используется в фотографии, особенно в традиционной чёрно-белой фотопечати. Он входит в состав светочувствительных эмульсий на основе бромида серебра. Хотя цифровая фотография вытеснила плёночную, KBr всё ещё используется в учебных и научных целях, а также в художественной фотопечати.
Также соединение используется в производстве специальных видов стекла и в лабораторной практике как реактив. В некоторых случаях KBr применяется в качестве компонента буровых растворов при добыче нефти и газа.
Бромид калия остаётся ценным веществом в ряде узкоспециализированных сфер, несмотря на сокращение его применения в медицине.
Сообщение
Применение хлорида кальция
Хлорид кальция (CaCl₂) — соединение с огромным промышленным, коммунальным и бытовым значением. Он хорошо растворим в воде и обладает сильными гигроскопическими свойствами, что делает его эффективным влагопоглотителем. В быту и промышленности его используют в качестве осушителя воздуха, упаковок и помещений, где требуется поддержание низкой влажности.
Одна из наиболее известных областей применения CaCl₂ — борьба с обледенением. Его применяют для посыпки дорог, тротуаров и других поверхностей зимой, поскольку он эффективно понижает температуру замерзания воды, способствует таянию льда и предотвращает образование наледи. В отличие от поваренной соли, он действует при более низких температурах и менее агрессивен по отношению к бетону.
В пищевой промышленности CaCl₂ используется в качестве пищевой добавки (E509) — для укрепления текстуры продуктов (например, при производстве сыра или консервированных овощей), а также в технологии производства напитков, чтобы повысить уровень кальция. В медицинской практике растворы хлорида кальция применяются для восполнения дефицита кальция в организме, при аллергических реакциях и других показаниях.
В строительной индустрии CaCl₂ добавляют в бетонные смеси для ускорения схватывания цемента и повышения морозостойкости. Также он используется в нефтедобыче, холодильной технике, химическом производстве и при осушении газов.
Таким образом, хлорид кальция — это универсальное вещество с широчайшим спектром применения в промышленности, медицине, коммунальной сфере и быту.
12. Объясните, почему аммиак используют в промышленных холодильных установках.
Аммиак (NH₃) широко применяют в промышленных холодильных установках благодаря его высокой эффективности в качестве хладагента. У него отличные термодинамические свойства — он обладает большой скрытой теплотой испарения, то есть при переходе из жидкого состояния в пар он поглощает значительное количество тепла, эффективно охлаждая окружающую среду.
Кроме того, аммиак дёшев, легко доступен и хорошо обнаруживается по запаху при утечках, что повышает безопасность эксплуатации. Он не разрушает озоновый слой и при правильном обращении экологически безопаснее многих фреонов. Всё это делает аммиак популярным выбором в пищевой промышленности, на ледовых аренах и других объектах, где необходима мощная и надёжная система охлаждения.






