Решебник по химии 9 класс Габриелян §16
§16
Общая характеристика элементов VA-группы. Азот
Стр. 87
Вопрос
Шотландский учёный Даниель Резерфорд в 1772 г. проводил эксперименты по сжиганию под стеклянным колпаком древесного угля, серы и фосфора. Продукты горения поглощались раствором щёлочи. Резерфорд установил, что оставшаяся после эксперимента часть воздуха — это газ, в котором свеча не горит, а мышь гибнет. О каком газе идёт речь?
Речь идёт об азоте (N₂) — основном компоненте воздуха, который не поддерживает горение и дыхание. Даниель Резерфорд фактически стал первым учёным, открывшим азот, хотя он сам назвал его «испорченный воздух». В своём эксперименте он удалил из воздуха кислород (с помощью горения и поглощения продуктов реакции щёлочью), а оставшаяся часть оказалась именно азотом. Поскольку в этом газе не может гореть свеча и умирает мышь, он не поддерживает жизнь — отсюда позднее и пошло его название: азот, что в переводе с греческого означает «безжизненный».
Стр. 89
Проверьте свои знания
1. Дайте общую характеристику элементов VA-группы на основании их положения в Периодической системе Д. И. Менделеева. Укажите закономерности изменения радиуса атома, электроотрицательности, неметаллических свойств с ростом атомного номера элемента.
Элементы VA-группы Периодической системы включают: азот (N), фосфор (P), мышьяк (As), сурьму (Sb), висмут (Bi) и московий (Mc). На внешнем энергетическом уровне атомов этих элементов содержится пять электронов. До завершения устойчивой восьмиэлектронной оболочки не хватает трёх электронов, что обуславливает их способность проявлять степень окисления −3 в соединениях, где они выступают восстановителями, принимая три электрона.
Азот и фосфор — неметаллы, As и Sb — металлоиды, Bi и Mc — типичные металлы. Это объясняется увеличением атомного радиуса и снижением электроотрицательности при движении сверху вниз по группе. Уменьшается неметаллический характер, растёт металлический. Радиус атомов увеличивается, так как возрастает число энергетических уровней. Электроотрицательность снижается, следовательно, элементы хуже притягивают электроны.
Максимальная степень окисления элементов этой группы — +5. Она возможна, когда все пять валентных электронов вовлечены в химическую связь, например, в HNO₃ (азот в степени окисления +5) или P₂O₅ (фосфор в степени +5). У более тяжёлых представителей, например Bi, степень окисления +5 проявляется реже из-за проявления инертной пары s-электронов.
2. В чём причина малой химической активности простого вещества азота?
Азот в простом веществе существует в виде двухатомных молекул N₂, в которых между атомами азота образована тройная ковалентная неполярная связь. Эта связь очень прочная и стабильная, так как три общие электронные пары создают прочную молекулу с высокой энергией связи. Именно наличие тройной связи N≡N объясняет низкую химическую активность молекулярного азота при обычных условиях.
Чтобы разорвать эту прочную связь, необходимо затратить значительное количество энергии, поэтому реакции с участием азота, например с водородом или металлами, протекают только при высоких температурах, в электрической дуге или при наличии катализаторов. Благодаря своей инертности азот широко используется для создания инертной атмосферы в промышленности и лабораториях.
Стр. 89
Примените свои знания
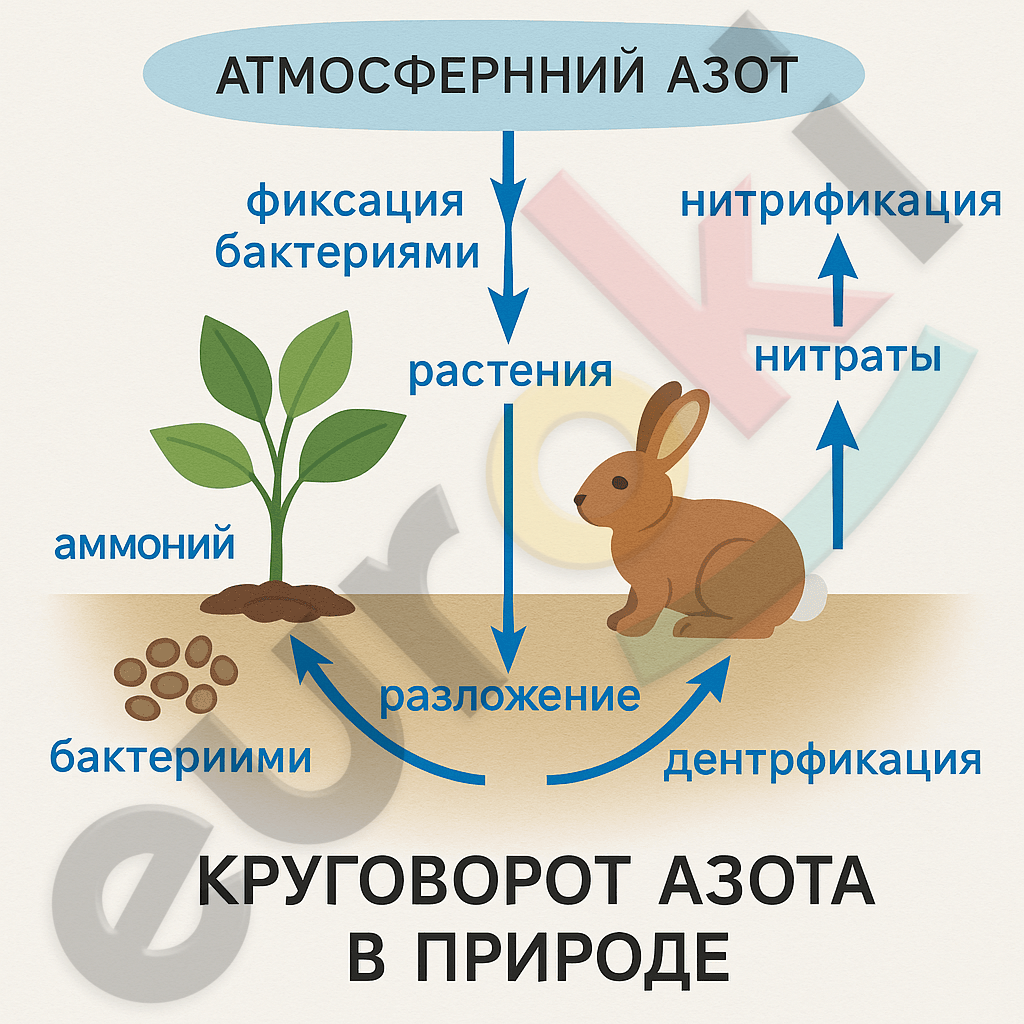
3. Используя знания по биологии, охарактеризуйте биологическую роль азота. Нарисуйте схему круговорота азота в природе.
Азот играет ключевую роль в биологических процессах. Он входит в состав аминокислот, из которых строятся белки, а также в состав нуклеиновых кислот — ДНК и РНК, участвующих в передаче наследственной информации. Азот необходим для синтеза АТФ — источника энергии в клетках.
Большая часть азота в атмосфере находится в виде молекулярного газа N₂, который недоступен для большинства живых организмов. Однако некоторые бактерии (азотфиксирующие бактерии, например, клубеньковые бактерии у бобовых растений) способны фиксировать атмосферный азот и превращать его в доступные формы: аммоний (NH₄⁺) и нитраты (NO₃⁻). Эти соединения усваиваются растениями, затем через пищевые цепи попадают к животным и человеку. После гибели организмов и разложения их останков, бактерии снова превращают органический азот в аммоний, а затем в нитриты и нитраты. Нитратные соединения могут снова быть поглощены растениями либо разлагаться денитрифицирующими бактериями до молекулярного азота, который возвращается в атмосферу.
Таким образом, замыкается круговорот азота в природе, обеспечивающий постоянное участие азота в биосфере.
(Схему круговорота можно нарисовать по следующему принципу:
Атмосферный азот → фиксация бактериями → аммоний → растения → животные → разложение → нитрификация → денитрификация → атмосфера).
4. Какой объём газообразного азота может быть получен из 1000 м³ воздуха (н. у.), если потери в процессе фракционной перегонки сжиженного воздуха составляют 15 %? Объёмная доля азота в воздухе составляет 78 %.
Шаг 1. Определим теоретический объём азота в 1000 м³ воздуха:
1000 м³ × 0,78 = 780 м³
Шаг 2. Учтём потери 15 % при фракционной перегонке:
Потери: 780 м³ × 0,15 = 117 м³
Оставшийся объём: 780 м³ − 117 м³ = 663 м³
Ответ: из 1000 м³ воздуха можно получить 663 м³ газообразного азота с учётом потерь.
Стр. 89
Выразите свое мнение
5. Вы уже знаете, что название «азот» предложил Антуан Лоран Лавуазье. Это произошло в 1787 г. Как переводится это слово? Почему некоторые современники учёного считали данное им название неудачным? Отражает ли оно свойства азота? Аргументируйте свою точку зрения.
Слово «азот» произошло от греческого «ἄζωον» (азоон), что означает «безжизненный» («а» — отрицательная частица, «зоон» — жизнь). Такое название азоту дал французский химик Антуан Лоран Лавуазье в 1787 году. Он исходил из того, что при вдыхании азота животное погибает, так как газ не поддерживает дыхание и горение, то есть не пригоден для жизни в чистом виде.
Однако некоторые современники Лавуазье считали название неудачным, потому что оно подчёркивает только одну — отрицательную особенность вещества, не отражая его общей роли и многообразия химических свойств. Считалось, что название «безжизненный» вводит в заблуждение, так как азот — важнейший элемент живой природы. Он входит в состав белков, нуклеиновых кислот, аминокислот и АТФ. Без него невозможны процессы роста, деления клеток, передачи наследственности.
С другой стороны, название «азот» частично отражает свойства элемента, так как молекулярный азот (N₂) действительно химически пассивен и не поддерживает горение и дыхание. Однако оно не учитывает его активность в соединениях и жизненную важность.
Таким образом, название отражает только одну сторону характеристик азота — его инертность в свободном виде, но не отражает его значения для жизни, поэтому может считаться частично удачным, но неполным.
Стр. 89
Используйте дополнительную информацию
6. Подготовьте сообщение об азотных удобрениях.
Сообщение
Азотные удобрения: значение, виды, применение
Азотные удобрения — одна из важнейших групп минеральных удобрений, широко применяемых в сельском хозяйстве для повышения урожайности растений. Главным действующим веществом этих удобрений является азот — химический элемент, входящий в состав аминокислот, белков, ферментов и хлорофилла, то есть жизненно важен для нормального роста и развития растений. В природных условиях азот попадает в почву в результате атмосферных осадков, разложения органических остатков и деятельности азотфиксирующих бактерий. Однако этого количества недостаточно для получения высоких урожаев, особенно на истощённых или бедных почвах. Поэтому сельское хозяйство активно использует азотные удобрения, производимые промышленным путём.
Все азотные удобрения делятся на три основные группы: нитратные, аммонийные и амидные. К нитратным удобрениям относится, например, селитра — вещество, содержащее нитрат-ион NO₃⁻. Примерами являются натриевая селитра (NaNO₃) и кальциевая селитра (Ca(NO₃)₂). Эти удобрения быстро растворяются в воде, хорошо усваиваются растениями и особенно эффективны в условиях достаточного увлажнения. Однако они легко вымываются из почвы, поэтому требуют осторожного использования, чтобы избежать загрязнения грунтовых вод.
К аммонийным удобрениям относят сульфат аммония ((NH₄)₂SO₄) и хлорид аммония (NH₄Cl). Эти соединения содержат азот в форме иона аммония NH₄⁺, который медленнее вымывается из почвы и дольше сохраняется в ней. При этом аммонийные удобрения способны подкислять почву, что необходимо учитывать при их использовании.
Наиболее известным амидным азотным удобрением является карбамид (мочевина) — CO(NH₂)₂. Это концентрированное азотное удобрение (содержит около 46% азота), которое медленно превращается в аммоний и затем в нитрат. Благодаря этому мочевина действует длительно и даёт устойчивый эффект. Она может применяться как в качестве основного удобрения при вспашке, так и для внекорневой подкормки в виде растворов.
Азотные удобрения активно применяются для подкормки всех основных культур: зерновых (пшеница, кукуруза, ячмень), корнеплодов (картофель, свёкла), овощей и плодовых растений. Они усиливают рост зелёной массы, способствуют ускоренному развитию растений, повышают содержание белков в урожае. Особенно важно вносить азот весной и в начале лета — в период активного роста.
Однако чрезмерное внесение азота может привести к негативным последствиям: вымыванию нитратов в водоёмы, нарушению баланса питательных веществ в почве, избыточному наращиванию зелёной массы в ущерб цветению и плодоношению. Кроме того, накопление нитратов в пищевых растениях может быть опасно для здоровья человека. Поэтому необходимо строго соблюдать нормы внесения и чередовать азотные удобрения с фосфорными и калийными.
Производство азотных удобрений основано на синтезе аммиака из водорода и азота воздуха по реакции Габера-Боша:
(N₂ + 3H₂ → 2NH₃)
Аммиак затем используется для получения различных азотных соединений, пригодных к применению в сельском хозяйстве. Предприятия, производящие азотные удобрения, находятся вблизи источников дешёвого природного газа (сырья для получения водорода).
В заключение, азотные удобрения играют ключевую роль в современном сельском хозяйстве, повышая продуктивность полей и обеспечивая продовольственную безопасность. Их грамотное применение требует понимания химических свойств, взаимодействия с почвой и культуры агротехнического подхода.






