Решебник по химии 9 класс Габриелян §17
§17
Аммиак. Соли аммония
Стр. 90
Вопрос
Соединения, содержащие азот в минимальной степени окисления –3, могут проявлять только восстановительные свойства. Какие реакции характерны для таких соединений?
Соединения, в которых азот находится в степени окисления –3 (например, аммиак NH₃, нитриды металлов), являются сильными восстановителями. Это связано с тем, что азот в этих соединениях уже приобрёл три электрона и не может отдавать их дальше — он может лишь отдавать электроны обратно, повышая свою степень окисления.
Характерные реакции для таких соединений — реакции окисления, в которых азот переходит от степени окисления –3 к более высоким степеням: 0, +2, +3 и т. д. Вот основные типы таких реакций:
Реакции с кислородом (сгорание аммиака):
(4NH₃ + 3O₂ → 2N₂ + 6H₂O) — азот окисляется до степени окисления 0.
Реакции с кислородом при наличии катализатора (платина):
(4NH₃ + 5O₂ → 4NO + 6H₂O) — азот окисляется до степени окисления +2.
Реакции с оксидами металлов (CuO, Cr₂O₃):
(2NH₃ + 3CuO → 3Cu + N₂ + 3H₂O)
(2NH₃ + Cr₂O₃ → N₂ + Cr + H₂O)
Разложение нитрида аммония (NH₄NO₂):
(NH₄NO₂ → N₂ + 2H₂O) — также идёт окисление азота.
Таким образом, для соединений с азотом в степени окисления –3 характерны восстановительные реакции, в которых они взаимодействуют с сильными окислителями, отдавая электроны и превращаясь в соединения с более высокой степенью окисления.
Стр. 90
Лабораторный опыт 35
Соберите прибор для получения газа и проверьте его на герметичность. В пробирку прибора поместите смесь кристаллических хлорида аммония и щёлочи. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки поднимите вверх и наденьте на него сухую пробирку. Под тягой прогрейте пробирку со смесью, а затем нагревайте её в том месте, где находятся реагенты. Что ощущаете? Через минуту снимите пробирку с аммиаком, и, не переворачивая, опустите отверстием в кристаллизатор с водой. Что наблюдаете? Закройте отверстие пробирки пальцем под водой, переверните её с полученным раствором, уберите палец и добавьте в раствор несколько капель раствора фенолфталеина. Что наблюдаете? Запишите уравнения реакции получения аммиака. Какой способ вы использовали для его собирания?
При нагревании смеси хлорида аммония (NH₄Cl) и щёлочи (например, NaOH) ощущается характерный резкий запах аммиака (NH₃). Это свидетельствует о том, что в ходе реакции выделяется аммиак — газ с резким запахом.
Когда сухую пробирку с аммиаком опускают отверстием в воду, можно наблюдать, как вода всасывается внутрь — это связано с тем, что аммиак хорошо растворяется в воде, создавая разрежение внутри пробирки.
Добавление фенолфталеина к полученному раствору приводит к окрашиванию в малиновый цвет, что свидетельствует о щелочной реакции среды. Это означает, что в воде образовался раствор аммиака — аммиачная вода, в которой есть ионы OH⁻.
Уравнение реакции получения аммиака:
(NH₄Cl + NaOH → NH₃↑ + NaCl + H₂O)
Способ собирания аммиака:
Так как аммиак легче воздуха и не растворяется в воде полностью, его собирали вверх вытеснением воздуха. Это подходящий способ, если не используется водяная баня или вытеснение воды.
Стр. 92
Лабораторный опыт 36
В пробирку налейте 2 мл раствора хлорида аммония и добавьте 2 мл раствора гидроксида натрия. Нагрейте пробирку. Поднесите к отверстию пробирки влажную лакмусовую бумагу. Что наблюдаете? О чём свидетельствует изменение окраски индикаторной бумаги?
При нагревании смеси раствора хлорида аммония (NH₄Cl) и гидроксида натрия (NaOH) происходит выделение аммиака (NH₃) — газа с резким характерным запахом. Этот газ взаимодействует с водой, содержащейся на влажной лакмусовой бумаге, и образует аммиачную воду, в которой присутствуют ионы OH⁻.
Если влажная лакмусовая бумага была красной, то под действием аммиака она окрашивается в синий цвет, что свидетельствует о щелочной реакции среды.
Химическое уравнение реакции:
(NH₄Cl + NaOH → NH₃↑ + NaCl + H₂O)
Вывод: Изменение окраски лакмусовой бумаги свидетельствует о том, что в ходе реакции выделяется аммиак, обладающий основными (щелочными) свойствами. Это подтверждается тем, что аммиак, растворяясь в воде, создаёт щелочную среду.
Стр. 93
Проверьте свои знания
1. Составьте схему образования химической связи в молекуле аммиака.
Молекула аммиака NH₃ состоит из атома азота и трёх атомов водорода. Азот имеет пять электронов на внешнем энергетическом уровне, из них одна неподелённая электронная пара и три неспаренных электрона. Каждый неспаренный электрон азота образует ковалентную неполярную связь с 1s-электроном атома водорода. В результате образуется три σ-связи между атомами N и H. Электронная формула связей:
![H:N:H]
Кроме того, у атома азота остаётся неподелённая пара электронов, способная участвовать в донорно-акцепторных взаимодействиях, например, при образовании иона аммония NH₄⁺.
2. Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Аммиак NH₃ — это бесцветный газ с резким, характерным запахом, легче воздуха, хорошо растворим в воде. Водный раствор аммиака называют аммиачной водой или нашатырным спиртом. Он имеет слабощелочную реакцию среды из-за обратимой диссоциации:
(NH₃·H₂O ⇄ NH₄⁺ + OH⁻)
Физические свойства: газ, хорошо растворяется в воде, при охлаждении переходит в жидкость.
Химические свойства: аммиак — основание, реагирует с кислотами, образуя соли (аммоний хлорид, сульфат аммония и др.), проявляет восстановительные свойства (например, восстанавливает оксиды металлов), может сгорать в кислороде, окисляясь до N₂ или NO.
Применение:
Исходное вещество для производства азотной кислоты, мочевины, аммонийных солей.
Хладагент в холодильных установках.
Аммиачная вода используется в медицине, быту, пищевой промышленности.
Аммиачные соли применяются как удобрения (нитрат аммония, фосфат аммония и др.).
3. Почему аммиак в окислительно-восстановительных реакциях проявляет свойства восстановителя?
Атом азота в аммиаке имеет степень окисления –3, то есть он максимально восстановлен. В окислительно-восстановительных реакциях азот может отдавать электроны (повышать степень окисления), превращаясь, например, в N⁰ (молекулярный азот) или в NO (+2). Таким образом, аммиак легко выступает в роли восстановителя.
Примеры:
(4NH₃ + 3O₂ → 2N₂ + 6H₂O)
(4NH₃ + 5O₂ → 4NO + 6H₂O)
4. В чём состоит донорно-акцепторный механизм образования ковалентной связи? Какой ещё механизм образования ковалентной связи вам известен? Подтвердите свой ответ схемой взаимодействия иона аммония.
Ковалентная связь может образовываться двумя способами:
за счёт обобществления неспаренных электронов двух атомов (обычная ковалентная связь);
за счёт предоставления одной пары электронов одним атомом (донором) и перехода на неё другого атома (акцептора) — это донорно-акцепторный механизм.
В молекуле аммиака есть неподелённая электронная пара у атома азота, которая может быть предоставлена иону H⁺, не имеющему электронов. Образуется ион аммония:
(NH₃ + H⁺ → NH₄⁺)
Азот — донор электронов, водород — акцептор.
Схема:
H:N: + H⁺ → [H–N–H]⁺ (ион аммония)
5. Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
Качественная реакция: к раствору соли аммония добавляют щёлочь и слегка нагревают. Образуется газ аммиак с резким запахом, изменяющий цвет лакмусовой бумажки на синий.
Ионное уравнение: (NH₄⁺ + OH⁻ → NH₃↑ + H₂O)
Пример молекулярного уравнения: ((NH₄)₂SO₄ + 2KOH → 2NH₃↑ + K₂SO₄ + 2H₂O)
Стр. 93
Примените свои знания
6. Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой. Какая из этих реакций является окислительно-восстановительной?
Нитрид натрия (Na₃N) получают при взаимодействии натрия с азотом:
(6Na + N₂ → 2Na₃N) — это реакция соединения и окислительно-восстановительная, так как:
азот восстанавливается от 0 до –3 (восстановитель — натрий),
натрий окисляется от 0 до +1 (окислитель — азот).
Реакция нитрида натрия с водой:
(Na₃N + 3H₂O → 3NaOH + NH₃↑) — это гидролиз и не является ОВР, так как степени окисления не меняются.
7. С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди(II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
С азотной кислотой:
(2NH₃ + H₂SO₄ → (NH₄)₂SO₄)
(2NH₃ + HNO₃ → NH₄NO₃)
С кислородом (в присутствии катализатора):
(4NH₃ + 3O₂ → 2N₂ + 6H₂O)
(4NH₃ + 5O₂ → 4NO + 6H₂O) — в присутствии платинового катализатора
С гидроксидом натрия:
Не реагирует напрямую (оба щёлочные вещества)
С водой:
(NH₃ + H₂O ⇄ NH₄⁺ + OH⁻)
С хлоридом калия:
Не реагирует
С оксидом меди(II):
(2NH₃ + 3CuO → 3Cu + N₂ + 3H₂O) — ОВР
С железом:
При обычных условиях не реагирует
С сульфатом аммония:
NH₃ — это часть сульфата аммония, не вступает в реакцию с ним
8. В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Ответ подтвердите уравнениями соответствующих реакций.
Добавим щёлочь (например, NaOH):
В растворе хлорида аммония (NH₄Cl) выделится аммиак, с характерным запахом:
(NH₄Cl + NaOH → NH₃↑ + NaCl + H₂O)
С раствором хлорида натрия (NaCl) никакой реакции не произойдёт.
Это позволяет отличить растворы по запаху и реакции с индикатором (лакмус или фенолфталеин изменят цвет из-за аммиака).
9. В 150 мл воды растворили 67,2 г аммиака (н. у.). Рассчитайте массовую долю аммиака в полученном растворе.
Найдём массу аммиака:
67,2 л (н.у.) — это 3 моль NH₃, так как:
(22,4 л/моль → 1 моль, 67,2 л / 22,4 л/моль = 3 моль)
Масса NH₃:
(3 моль × 17 г/моль = 51 г)
Масса раствора = масса воды + масса аммиака = 150 г + 51 г = 201 г
Массовая доля аммиака:
(ω = (51 г / 201 г) × 100% ≈ 25,37%)
Ответ: массовая доля аммиака составляет приблизительно 25,4%.
Стр. 93
Выразите свое мнение
10. Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония. Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения?
На круговых диаграммах изображены массовые доли азота в четырёх различных солях. Видно, что самой богатой на азот является нитрат аммония (NH₄NO₃) — в его составе содержится около 35% азота по массе. Далее по содержанию азота идут: сульфат аммония ((NH₄)₂SO₄) с 21,2%, нитрат кальция (Ca(NO₃)₂) — 17,1% и нитрат калия (KNO₃) — 13,9%.
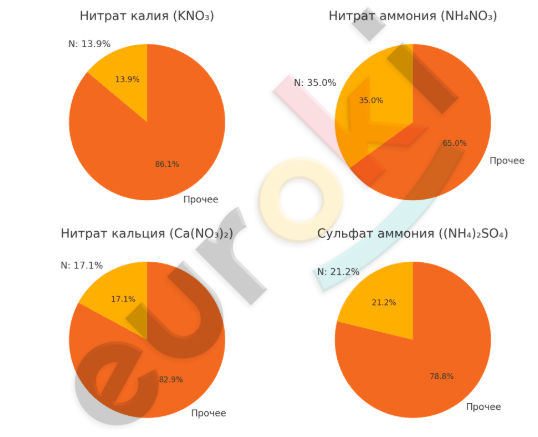
Следовательно, в качестве азотного удобрения лучше всего рекомендовать нитрат аммония, так как он содержит наибольшую массовую долю азота, что делает его особенно эффективным для питания растений.
Стр. 93
Используйте дополнительную информацию
11. Подготовьте сообщение по теме «Производство аммиака: от Габера до современности».
Сообщение
Производство аммиака: от Габера до современности
Аммиак (NH₃) — одно из важнейших химических соединений, которое широко используется в сельском хозяйстве, промышленности и медицине. Однако массовое производство аммиака стало возможным только в начале XX века благодаря усилиям выдающихся учёных и инженеров. История производства аммиака — это пример того, как наука, технология и экономика могут объединиться ради решения одной из самых насущных задач человечества: обеспечения населения продовольствием.
Проблема азота и рождение идеи
Азот — ключевой элемент для жизни. Он входит в состав белков, ДНК и РНК, а значит, необходим для роста всех живых организмов. Однако несмотря на то, что атмосфера Земли на 78 % состоит из азота (в форме молекул N₂), этот газ химически инертен, и растения не могут его усваивать напрямую. В природе азот превращается в соединения, пригодные для биологических нужд, через процессы азотфиксации — естественные (бактериями в почве) и электрические (в атмосфере при грозах).
Но с развитием сельского хозяйства в XIX веке стало ясно, что естественных источников соединений азота (например, гуано, чилийской селитры) недостаточно для удовлетворения потребностей населения. Мир нуждался в способе синтеза азотных соединений, прежде всего аммиака, в промышленных масштабах.
Габер и Бош — пионеры промышленного синтеза аммиака
Прорыв произошёл благодаря немецкому химику Фрицу Габеру. В 1908 году он разработал лабораторный метод синтеза аммиака из водорода и азота:
N₂ + 3H₂ ⇄ 2NH₃ (ΔH < 0)
Реакция экзотермическая, обратимая, и для её осуществления требуются высокое давление (150–300 атм), высокая температура (400–500 °C) и катализатор (обычно железо с добавками калия и алюминия). Эти условия позволили сдвинуть равновесие реакции в сторону образования аммиака и ускорить её скорость.
Однако лабораторный успех Габера не означал автоматической победы. Необходима была промышленная реализация. Этим занялся инженер Карл Бош, который совместно с концерном BASF к 1913 году построил первый завод по производству аммиака. Так появился процесс Габера-Боша, положивший начало химической революции в аграрном секторе. Этот метод позволил синтезировать тонны аммиака и, следовательно, производить нитратные удобрения, без которых сегодня невозможно представить сельское хозяйство.
Значение и роль в XX веке
Процесс Габера-Боша имел огромное значение не только для сельского хозяйства, но и для военной промышленности. Аммиак стал исходным веществом для получения азотной кислоты (по реакции окисления аммиака в кислороде), а затем — нитратов, используемых для производства взрывчатых веществ. Именно поэтому Габера называют «человеком, который накормил миллионы — и убил миллионы», ведь его изобретение сыграло роль и в обеспечении продовольствием, и в усилении военного потенциала стран.
Во второй половине XX века производство аммиака достигло глобального масштаба. Оно стало основой для выпуска азотных удобрений: мочевины, аммонийных солей (NH₄NO₃, (NH₄)₂SO₄), карбамида. Эти вещества увеличили урожайность в несколько раз и позволили накормить растущее население планеты.
Современные технологии и экологические вызовы
Сегодня аммиак производят примерно в 60 странах мира, а общий объём производства превышает 200 миллионов тонн в год. Основное сырьё — природный газ (метан), из которого получают водород методом паровой конверсии:
CH₄ + H₂O ⇄ CO + 3H₂
CO + H₂O ⇄ CO₂ + H₂
Затем водород соединяют с азотом воздуха, и в реакторах синтеза аммиака происходит основной процесс. Азот получают путём фракционной перегонки жидкого воздуха или путём мембранного разделения газов.
Однако такой способ связан с большими затратами энергии, высоким давлением, использованием ископаемого топлива (метана) и выбросами углекислого газа (CO₂). Это делает производство аммиака значимым источником парниковых газов — около 1–2% мировых выбросов CO₂ приходится на него.
Будущее производства аммиака — зелёные технологии
Современные учёные ищут альтернативные пути получения аммиака, чтобы снизить вред для экологии. Один из таких путей — «зелёный аммиак», получаемый из водорода, полученного с помощью электролиза воды, а не из метана. Если электроэнергия для электролиза поступает от возобновляемых источников (ветра, солнца), то весь процесс становится углеродно-нейтральным.
Кроме того, ведутся разработки катализаторов, способных проводить синтез аммиака при более низких температурах и давлениях, что может значительно сократить энергозатраты.
Заключение
Путь аммиака от лаборатории Габера до современных экологически чистых технологий — это путь научного гения, инженерного труда и глобального влияния. Без аммиака невозможно представить себе современное сельское хозяйство, производство удобрений, очистку сточных вод, фармацевтику и многое другое. При этом человечество стоит перед задачей сохранить эффективность синтеза аммиака, минимизировав при этом вред окружающей среде. Новое поколение химиков и инженеров работает над тем, чтобы аммиак оставался не только основой урожайности, но и союзником устойчивого развития.
12. Объясните, почему аммиак используют в промышленных холодильных установках.
Аммиак (NH₃) широко используют в промышленных холодильных установках по нескольким причинам:
Высокая теплота испарения. Аммиак поглощает большое количество тепла при испарении, благодаря чему он очень эффективно охлаждает окружающую среду. Это делает его превосходным хладагентом для холодильных машин.
Хорошая теплопередача. Аммиак имеет высокую теплопроводность, что позволяет ему эффективно передавать тепло в системах охлаждения.
Низкая стоимость. Аммиак — сравнительно дешёвое и доступное вещество, что делает его экономически выгодным выбором для использования в промышленности.
Лёгкое обнаружение утечек. Аммиак обладает резким характерным запахом, благодаря чему утечки можно легко обнаружить, что важно для безопасности.
Экологичность. В отличие от многих фреонов, аммиак не разрушает озоновый слой и не является парниковым газом, что делает его более безопасным с экологической точки зрения.
Хорошие физико-химические свойства. Он легко сжижается при умеренных давлениях, имеет низкую температуру кипения (–33,4 °C), что позволяет использовать его в различных условиях.
Именно благодаря этим свойствам аммиак до сих пор применяется в крупных холодильных установках, например, на предприятиях пищевой промышленности.
Стр. 94
Практическая работа 4
1. Получение аммиака и его водного раствора.
При проведении описанного опыта наблюдается выделение аммиака (NH₃), который образуется в результате реакции между хлоридом аммония и гидроксидом кальция. Аммиак — газ с резким запахом, легче воздуха, малорастворим в воде. В опыте подтверждается его присутствие по изменению окраски универсальной индикаторной бумаги (в щелочную сторону — с жёлтой на синюю или с красной на фиолетовую), так как аммиак в воде образует слабое основание — гидрат аммиака (нашатырный спирт).
Газ собирается над водой в приёмник, что доказывает, что он растворим в воде, и при охлаждении или контакте с водой может образовывать раствор — аммиачную воду. При поднесении влажной индикаторной бумаги к отверстию пробирки с аммиаком наблюдается её посинение, что указывает на наличие в газе гидроксид-ионов (OH⁻), образующихся при диссоциации аммиака в воде:
(NH₄)₂SO₄ + 2KOH → 2NH₃↑ + K₂SO₄ + 2H₂O
NH₃ + H₂O ⇄ NH₄⁺ + OH⁻
Таким образом, в ходе опыта осуществляется получение аммиака и его растворение в воде, что позволяет наглядно изучить его физические и химические свойства: летучесть, щелочную реакцию и растворимость.
2. Изучение химических свойств водного раствора аммиака.
После добавления фенолфталеина в одну из пробирок с раствором аммиака наблюдается малиновое окрашивание раствора. Это подтверждает щелочную среду, так как аммиак в воде частично диссоциирует, образуя гидроксид-ионы (NH₃ + H₂O ⇄ NH₄⁺ + OH⁻).
При добавлении в эту же пробирку раствора соляной кислоты окраска исчезает, так как происходит нейтрализация щёлочи кислотой. Молекулярное уравнение реакции:
(NH₄)OH + HCl → NH₄Cl + H₂O
Ионное уравнение:
OH⁻ + H⁺ → H₂O
Во второй пробирке при добавлении раствора хлорида алюминия наблюдается выпадение белого студенистого осадка гидроксида алюминия, так как аммиак вызывает гидролиз:
AlCl₃ + 3NH₄OH → Al(OH)₃↓ + 3NH₄Cl
Ионное уравнение:
Al³⁺ + 3OH⁻ → Al(OH)₃↓
После снятия ватки с газоотводной трубки и повторного нагревания пробирки снова выделяется аммиак, о чём можно судить по запаху и по реакции с влажной лакмусовой бумагой (посинение).
Если к отверстию трубки поднести палочку, смоченную соляной кислотой, образуется белый дым — это образование хлорида аммония:
NH₃ + HCl → NH₄Cl↓
Этот дым свидетельствует о наличии аммиака в газообразной форме и его способности вступать в реакцию с кислотами. Установка разбирается, рабочее место приводится в порядок.






