Решебник по химии 9 класс. Рудзитис ФГОС §4
§4
Обратимые реакции. Понятие о химическом равновесии
Стр. 23
Вопросы
1. Какие типы химических реакций вы знаете?
Существуют разные типы химических реакций, которые классифицируются по разным признакам. Один из главных — это число и состав исходных веществ и продуктов реакции. По этому признаку выделяют:
Реакции соединения — из двух или более веществ образуется одно новое: (2H₂ + O₂ → 2H₂O)
Реакции разложения — одно вещество распадается на два или более: (2HgO → 2Hg + O₂)
Реакции замещения — один элемент замещает другой в соединении: (Zn + 2HCl → ZnCl₂ + H₂)
Реакции обмена — два сложных вещества обмениваются своими составными частями: (BaCl₂ + Na₂SO₄ → BaSO₄↓ + 2NaCl)
Также реакции делят по тепловому эффекту на:
— экзотермические (идут с выделением тепла, например: (C + O₂ → CO₂ + Q)),
— эндотермические (идут с поглощением тепла, например: (CaCO₃ → CaO + CO₂ – Q)).
И по изменению степеней окисления на:
— окислительно-восстановительные (вещества отдают или принимают электроны),
— неокислительно-восстановительные (степени окисления не меняются).
Стр.24
Подумай, ответь, выполни
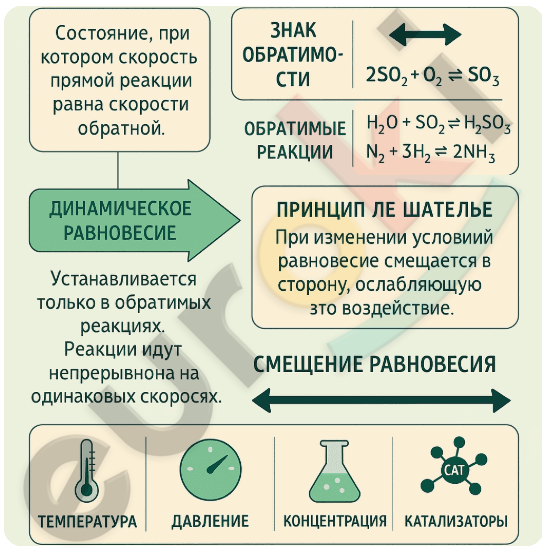
1. Составьте инфографику о состоянии химического равновесия.
Инфографика о химическом равновесии должна включать следующие ключевые элементы:
— Определение: Химическое равновесие — это состояние, при котором скорость прямой реакции равна скорости обратной.
— Условие: оно устанавливается в обратимых реакциях и является динамическим, то есть обе реакции продолжаются, но без изменения общего состава веществ.
— Примеры обратимых реакций:
(2SO₂ + O₂ ⇄ 2SO₃),
(H₂O + SO₂ ⇄ H₂SO₃),
(N₂ + 3H₂ ⇄ 2NH₃)
— Знак обратимости ⇄ используется вместо знака равенства.
— Правило Ле Шателье: при изменении внешних условий равновесие смещается в ту сторону, которая ослабляет это воздействие.
— Влияющие факторы: температура, давление, концентрация, катализаторы (ускоряют достижение равновесия, но не смещают его).
— Смещение равновесия в сторону продуктов или исходных веществ можно показать стрелками вправо или влево.
— Области применения: синтезы (аммиака, серной кислоты), металлургия, фармацевтика.
2. Определите, в каком направлении сместится равновесие а) при увеличении концентрации одного из исходных веществ, б) при повышении температуры; в) при понижении температуры — на примере следующих реакций:
а) (3O₂ ⇄ 2O₃ – Q)
б) (2H₂O ⇄ 2H₂ + O₂ – Q)
в) (C₃H₆ + H₂ ⇄ C₃H₈ + Q)
а) При увеличении концентрации кислорода (O₂) равновесие сместится вправо — в сторону образования озона (O₃), чтобы «израсходовать» добавленный реагент. При повышении температуры, так как реакция экзотермическая (–Q), равновесие сместится влево — в сторону поглощения тепла.
б) Повышение температуры также сместит равновесие влево — в сторону разложения воды, потому что реакция экзотермическая (–Q). Понижение температуры — вправо, в сторону образования воды.
в) Поскольку реакция сопровождается выделением теплоты (экзотермическая), при понижении температуры равновесие сместится вправо — в сторону образования пропана (C₃H₈), усиливая выделение тепла.
Таким образом, для экзотермических реакций повышение температуры смещает равновесие влево (в сторону реагентов), а понижение — вправо (в сторону продуктов).
3. Для какой химической реакции понижение температуры повлияет на смещение химического равновесия в сторону образования продуктов реакции?
а) (3O₂ ⇄ 2O₃ – Q)
б) (2H₂O ⇄ 2H₂ + O₂ – Q)
в) (C₃H₆ + H₂ ⇄ C₃H₈ + Q)
Понижение температуры смещает химическое равновесие в сторону экзотермической реакции, то есть туда, где происходит выделение теплоты (в сторону «+Q»).
Во всех трёх уравнениях продукты образуются с выделением теплоты (Q), то есть эти реакции — экзотермические. Значит, при понижении температуры равновесие сместится вправо — в сторону образования продуктов.
Поэтому правильный ответ — все три реакции соответствуют условию задания. Но если требуется выбрать одну, то самым очевидным примером является:
в) (C₃H₆ + H₂ ⇄ C₃H₈ + Q)
Ответ: в) — при понижении температуры равновесие смещается в сторону образования C₃H₈, то есть продуктов реакции.
4. Вычислите объём кислорода, необходимого для окисления 6,4 г оксида серы(IV).
Уравнение реакции: (2SO₂ + O₂ → 2SO₃)
Найдём количество вещества SO₂ по массе:
Mr(SO₂) = 32 + 2×16 = 64 г/моль
n(SO₂) = 6,4 г / 64 г/моль = 0,1 моль
По уравнению видно: 2 моль SO₂ реагирует с 1 моль O₂, значит, 0,1 моль SO₂ потребует 0,05 моль O₂
Найдём объём кислорода при нормальных условиях (1 моль газа = 22,4 л):
V(O₂) = 0,05 моль × 22,4 л/моль = 1,12 л
Ответ: для окисления 6,4 г SO₂ потребуется 1,12 л кислорода.
Стр. 25
Тестовые задания
1. Верны ли суждения о состоянии химического равновесия?
А. В состоянии химического равновесия скорости прямой и обратной реакций равны.
Б. В состоянии химического равновесия концентрации исходных веществ и продуктов реакции равны.
верно только А
верно только Б
верно оба суждения
оба суждения неверны
Суждение А — верное: в состоянии химического равновесия скорость прямой и обратной реакций действительно становится одинаковой.
Суждение Б — неверное: при химическом равновесии концентрации веществ могут быть разными, но они остаются постоянными.
Правильный ответ: 1) верно только А
2. Для смещения химического равновесия реакции (2NO + O₂ ⇄ 2NO₂ + Q) в сторону образования оксида азота(IV) необходимо
повысить температуру
понизить температуру
уменьшить давление
увеличить давление
увеличить концентрацию оксида азота(II)
Реакция (2NO + O₂ ⇄ 2NO₂ + Q) — экзотермическая (идёт с выделением теплоты), а также сопровождается уменьшением объёма (из 3 моль газов образуется 2 моль).
Чтобы сместить равновесие вправо (в сторону NO₂), нужно:
— понизить температуру (т.к. это экзотермическая реакция),
— увеличить давление (т.к. число молей газов уменьшается).
Правильный ответ: 2) и 4) — но в формате теста выбираем **наиболее подходящий вариант:
Правильный ответ: 4) увеличить давление.
Стр. 25
С помощью Интернета
1. Используя Интернет, ознакомьтесь с биографией французского ученого Анри Ле Шателье.
Анри Ле Шателье — основоположник принципа химического равновесия
Анри Луи Ле Шателье (Henri Louis Le Chatelier) — выдающийся французский физикохимик, вошедший в историю науки как автор фундаментального принципа, описывающего поведение химических систем в состоянии равновесия при воздействии внешних факторов. Его имя прочно связано с развитием химической термодинамики, металлургии и промышленной химии. Ле Шателье оказал огромное влияние не только на теоретическую химию, но и на практическое применение химических знаний в производстве.
Анри Ле Шателье родился 8 октября 1850 года в Париже в семье инженера Людовика Ле Шателье. С самого детства Анри находился в атмосфере науки и техники. Его отец был видным инженером и преподавателем в Политехнической школе, где позже учился и сам Анри. Строгое воспитание и богатая научная среда сыграли решающую роль в становлении будущего учёного. Он получил блестящее образование, обучаясь в Высшей нормальной школе и Политехнической школе Парижа, а затем стал профессором химии в знаменитой Сорбонне.
Одним из важнейших достижений Ле Шателье стал сформулированный им в 1884 году принцип смещения равновесия, более известный сегодня как принцип Ле Шателье. Он гласит: если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменение давления, температуры, концентрации), то равновесие сместится в ту сторону, которая ослабляет это воздействие. Эта закономерность позволила учёным и инженерам управлять химическими процессами — ускорять нужные реакции, повышать выход продуктов, оптимизировать условия производства.
Принцип Ле Шателье особенно важен при работе с обратимыми реакциями, когда продукты могут превращаться обратно в исходные вещества. Его идеи легли в основу многих технологий, включая синтез аммиака (процесс Габера-Боша), производство серной кислоты и других промышленных процессов. Ле Шателье доказал, что изменение внешних условий оказывает глубокое влияние на положение равновесия, что открыло перед химиками новые возможности для управления реакциями.
Помимо теоретических исследований, Ле Шателье активно занимался металлургией и разработкой новых строительных материалов, таких как цемент. Он создал лаборатории, в которых проводились опыты по изучению свойств металлов и их сплавов, разрабатывал методы термической обработки и занимался проблемами прочности материалов. Его работы имели большое значение для промышленности, особенно в металлургическом и строительном секторах.
Анри Ле Шателье был не только выдающимся учёным, но и активным общественным деятелем. Он уделял большое внимание научному образованию, преподавал в Коллеж де Франс, входил в состав Французской академии наук, где пользовался большим авторитетом. Он воспитал целую плеяду учеников и последователей, внёсших вклад в развитие химии и инженерных наук.
Ле Шателье обладал глубоким аналитическим умом, педантичностью в экспериментах и страстью к научному поиску. Его труды оказали влияние не только на химию, но и на физику, технику, экономику и даже философию науки. Он был сторонником применения научных знаний на благо общества, улучшения условий труда и повышения эффективности производств.
Анри Ле Шателье скончался 17 сентября 1936 года, оставив после себя богатое научное наследие. Его имя и сегодня изучают школьники и студенты по всему миру, а принцип, названный в его честь, является одним из краеугольных понятий в химии. Его вклад в науку без преувеличения можно назвать эпохальным, ведь он дал людям мощный инструмент для управления веществами и процессами на молекулярном уровне.






