Решебник по химии 9 класс Габриелян | Страница 11
Страница 11
Проверьте свои знания
1. Какие соединения называют бинарными? Какие бинарные соединения называют оксидами? На какие группы делятся оксиды? Приведите примеры оксидов каждой группы.
Бинарными называют соединения, состоящие из атомов двух химических элементов. Такие соединения могут быть образованы, например, металлом и неметаллом (например, NaH — гидрид натрия, Al₄C₃ — карбид алюминия) или двумя неметаллами (например, HCl — хлороводород).
Бинарные соединения, в состав которых входит кислород и ещё один элемент, называют оксидами. Это особая группа бинарных соединений, в которых кислород всегда имеет степень окисления -2. Оксиды делятся на две основные группы: солеобразующие и несолеобразующие.
Солеобразующими оксидами называют такие, которые вступают в реакцию с кислотами или щелочами с образованием соли и воды. Примеры: (CaO), (SO₃), (P₂O₅).
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами, то есть не образуют солей. Примеры: (CO), (NO), (N₂O).
2. Какие гидроксиды называют основаниями? Приведите примеры оснований каждой группы.
Основаниями называют гидроксиды, которые содержат ион металла и одну или несколько гидроксогрупп OH⁻. Такие соединения образуются при взаимодействии оксидов с водой или в результате других химических реакций. К основаниям относят гидроксиды металлов IА-группы (щелочные металлы) и IIА-группы (кроме бериллия), а также некоторых других металлов в низких степенях окисления.
Примеры оснований: — (NaOH) — гидроксид натрия, щёлочь; — (Ca(OH)₂) — гидроксид кальция; — (Fe(OH)₂) — гидроксид железа(II).
К амфотерным гидроксидам (относящимся к другой группе, а не к обычным основаниям) можно отнести, например, (Al(OH)₃), но их не относят к основаниям, так как они могут реагировать и с кислотами, и со щелочами.
3. На какие группы делятся кислоты? Приведите примеры кислот каждой группы.
Кислоты делятся на кислородсодержащие и бескислородные. Бескислородные кислоты состоят из водорода и неметалла, не содержащего кислород. Примеры: (HCl) — хлороводородная кислота, (H₂S) — сероводородная кислота.
Кислородсодержащие кислоты содержат атомы кислорода. Примеры: (H₂SO₄) — серная кислота, (HNO₃) — азотная кислота, (H₃PO₄) — фосфорная кислота.
4. Какие соединения называют солями? На какие группы делятся соли? Приведите примеры солей каждой группы.
Солями называют соединения, состоящие из ионов металла (или аммония NH₄⁺) и кислотного остатка. Соли образуются в результате замещения атомов водорода в кислотах на металл или в результате других химических реакций.
Соли делятся на следующие группы:
Средние соли — все атомы водорода в кислоте замещены металлом. Примеры: (NaCl), (MgSO₄), (Ca₃(PO₄)₂).
Кислые соли — не все атомы водорода в кислоте замещены металлом. Примеры: (NaHSO₄), (KHCO₃), (Ca(H₂PO₄)₂).
Основные соли — продукт частичного замещения гидроксогрупп в основании кислотным остатком. Примеры: (MgOHCl), (Cu(OH)CO₃).
Комплексные соли содержат сложный ион, заключённый в квадратные скобки. Примеры: [Ag(NH₃)₂]Cl, [Fe(CN)₆]³⁻.
5. Составьте формулы и укажите качественный и количественный состав следующих соединений:
— оксид железа(III)
— хлорид алюминия
— гидроксид бария
— гидрокарбонат меди(II)
— фосфат кальция
— аммиак.
Оксид железа(III)
Формула: (Fe₂O₃)
Качественный состав: железо (Fe), кислород (O)
Количественный состав: 2 атома Fe и 3 атома O
Хлорид алюминия
Формула: (AlCl₃)
Качественный состав: алюминий (Al), хлор (Cl)
Количественный состав: 1 атом Al и 3 атома Cl
Гидроксид бария
Формула: (Ba(OH)₂)
Качественный состав: барий (Ba), кислород (O), водород (H)
Количественный состав: 1 атом Ba, 2 атома O и 2 атома H
Гидрокарбонат меди(II)
Формула: (Cu(HCO₃)₂)
Качественный состав: медь (Cu), водород (H), углерод (C), кислород (O)
Количественный состав: 1 атом Cu, 2 атома H, 2 атома C, 6 атомов O
Фосфат кальция
Формула: (Ca₃(PO₄)₂)
Качественный состав: кальций (Ca), фосфор (P), кислород (O)
Количественный состав: 3 атома Ca, 2 атома P, 8 атомов O
Аммиак
Формула: (NH₃)
Качественный состав: азот (N), водород (H)
Количественный состав: 1 атом N и 3 атома H
6. Для характеристики качественного состава соединений рассчитайте массовые доли образующих их химических элементов.
Рассчитаем массовые доли элементов на примере гидроксида бария (Ba(OH)₂).
Найдём молярную массу вещества:
Ba = 137 г/моль
O = 16 г/моль (×2) = 32 г/моль
H = 1 г/моль (×2) = 2 г/моль
M(Ba(OH)₂) = 137 + 32 + 2 = 171 г/моль
Массовая доля каждого элемента:
ω(Ba) = (137 / 171) × 100% ≈ 80,12%
ω(O) = (32 / 171) × 100% ≈ 18,71%
ω(H) = (2 / 171) × 100% ≈ 1,17%
Ответ: В веществе Ba(OH)₂ массовая доля бария составляет примерно 80,12%, кислорода — 18,71%, водорода — 1,17%.
Стр. 11
Примените свои знания
7. Составьте в электронном виде обобщённую схему классификации веществ по составу, объединив схемы 2–3. Распечатайте полученную схему. Используйте схему для определения принадлежности веществ к тому или иному классу.
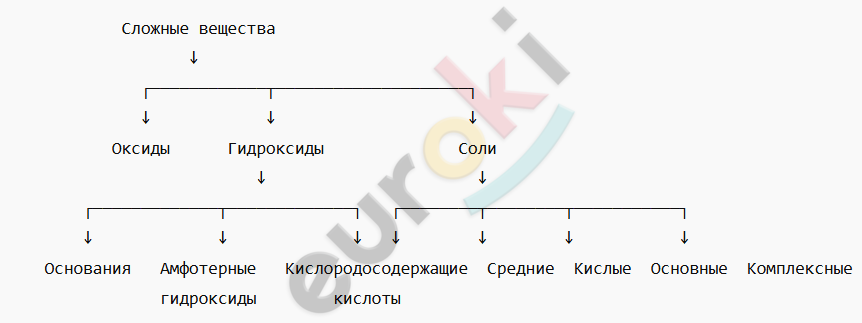
Эту схему можно использовать для классификации веществ по их составу: сначала определить, относится ли вещество к оксидам, гидроксидам или солям, а затем — к конкретному подтипу.
8. Распределите перечисленные ниже формулы веществ на четыре группы — оксиды, основания, кислоты, соли: Na₂SO₄, H₂, V₂O₅, KMnO₄, Ca(OH)₂, H₂CrO₄, NiO, CsOH, (NH₄)₂Cr₂O₇, Cu(OH)₂, Cl₂O, HCN. Дайте названия всех веществ.
Оксиды:
V₂O₅ — пентаоксид ванадия (оксид ванадия(V))
NiO — оксид никеля(II)
Cl₂O — монооксид хлора (оксид хлора(I))
Основания:
Ca(OH)₂ — гидроксид кальция
CsOH — гидроксид цезия
Cu(OH)₂ — гидроксид меди(II)
Кислоты:
H₂CrO₄ — хромовая кислота
HCN — циановодородная кислота (или синильная кислота)
Соли:
Na₂SO₄ — сульфат натрия (средняя соль)
KMnO₄ — перманганат калия (соль марганцовой кислоты)
(NH₄)₂Cr₂O₇ — дихромат аммония (соль двухосновной кислоты)
Дополнительно:
H₂ — водород (это простое вещество, а не соединение, ни к одной из групп не относится)
9. Вместо слов «гидроксид» и «соль» впишите в схемы формулы соответствующих веществ:
а) оксид натрия → гидроксид → соль
б) оксид цинка → гидроксид → соль
в) оксид азота(V) → гидроксид → соль
Укажите характер каждого гидроксида. Назовите соли.
а) (Na₂O) → (NaOH) → (Na₂SO₄)
Оксид натрия — основный оксид.
Гидроксид натрия — основание (щёлочь).
Соль: (Na₂SO₄) — сульфат натрия, средняя соль.
б) (ZnO) → (Zn(OH)₂) → (ZnSO₄)
Оксид цинка — амфотерный.
Гидроксид цинка — амфотерный гидроксид.
Соль: (ZnSO₄) — сульфат цинка, средняя соль.
в) (N₂O₅) → (HNO₃) → (NaNO₃)
Оксид азота(V) — кислотный.
Гидроксид (точнее, кислота) — азотная кислота HNO₃.
Соль: (NaNO₃) — нитрат натрия, средняя соль.
10. Воспользовавшись схемой, составленной при выполнении задания 7, приведите примеры известных вам соединений каждого класса в различных агрегатных состояниях. Совместно с учителем обсудите, в каждом ли классе веществ есть представители, находящиеся при обычных условиях в газообразном, жидком и твёрдом состояниях.
Ниже приведены примеры соединений по классам и агрегатным состояниям при обычных условиях (t = 25 °C, p = 1 атм):
Оксиды:
Газообразные: (CO₂), (NO₂)
Жидкие: (Cl₂O)
Твёрдые: (Fe₂O₃), (SiO₂)
Гидроксиды:
Газообразных — нет
Жидкие — отсутствуют (все гидроксиды, как правило, в растворе или твёрдые)
Твёрдые: (NaOH), (Al(OH)₃), (Ca(OH)₂)
Кислоты:
Газообразные: (HCl), (HF), (H₂S)
Жидкие: (H₂SO₄), (HNO₃)
Твёрдые: (H₃BO₃) — борная кислота
Соли:
Газообразных нет
Жидких — нет (все соли твёрдые при нормальных условиях)
Твёрдые: (NaCl), (KNO₃), (Ca₃(PO₄)₂)
Вывод
Не во всех классах веществ есть представители во всех трёх агрегатных состояниях. Например, соли и гидроксиды при обычных условиях существуют преимущественно в твёрдом виде, кислоты могут быть во всех трёх, а оксиды встречаются как в газообразной, так и в твёрдой форме, иногда — в жидкой.






