Решебник по химии 8 класс. Рудзитис ФГОС | Страница 210
Страница 210
Подумай, ответь, выполни
1. Объясните, почему численные значения электроотрицательности атомов элементов позволяют судить о виде химической связи, возникающей между ними. Приведите примеры.
Электроотрицательность — это способность атома притягивать к себе общие электронные пары. Зная численные значения электроотрицательности, можно определить, как распределяется электронная пара между атомами в соединении.
Если электроотрицательности атомов одинаковы или очень близки (разность ΔЭО < 0,4), связь считается ковалентной неполярной, например, в молекуле водорода (H₂) или хлора (Cl₂).
Если разность значений электроотрицательности составляет от 0,4 до 1,7, образуется ковалентная полярная связь — например, в молекулах воды (H₂O), аммиака (NH₃), хлороводорода (HCl).
Если же разность значений велика (больше 1,7), связь становится ионной, например, в соединениях NaCl, KF.
Таким образом, зная значения электроотрицательности, можно заранее предсказать тип химической связи между атомами
2. В тетрадях напишите по три формулы соединений: а) с ионной; б) с ковалентной полярной; в) с ковалентной неполярной связью. Изобразите их электронные формулы.
а) С ионной связью:
NaCl → [Na]⁺ + [Cl]⁻
KBr → [K]⁺ + [Br]⁻
CaF₂ → [Ca]²⁺ + 2[F]⁻
б) С ковалентной полярной связью:
HCl → H:Cl
H₂O → H:O:H
NH₃ → N:H₃
в) С ковалентной неполярной связью:
H₂ → H:H
Cl₂ → Cl:Cl
O₂ → O::O
(Точки обозначают электронные пары. В электронных формулах, например для воды:
O (6 электронов) + 2 H (по 1) образуют две общие пары, и у кислорода остаются 2 не поделенные пары.)
3. Изобразите структурные формулы молекул воды и хлороводорода.

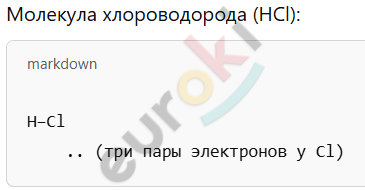
4. Учитывая значения электроотрицательностей элементов (см. табл. 19), составьте химические формулы и укажите свяжи общих электронных пар в соединениях: а) лития с азотом; б) кислорода с фтором; в) углерода с серой; г) углерода с алюминием.
а) Литий (Li = 1,0), азот (N = 3,0), ΔЭО = 2,0 → ионная связь.
Формула: Li₃N
Li отдаёт 1 электрон, N принимает 3 → 3Li⁺ + N³⁻
б) Кислород (O = 3,5), фтор (F = 4,0), ΔЭО = 0,5 → ковалентная полярная связь.
Формула: OF₂
Кислород образует 2 связи с фтором, у каждого фтора по 1 общей паре электронов с кислородом.
в) Углерод (C = 2,5), сера (S = 2,5), ΔЭО = 0 → ковалентная неполярная связь.
Формула: CS₂
C — 4 валентных электрона, S — 6. Углерод образует по 2 двойные связи с каждой серой.
г) Углерод (C = 2,5), алюминий (Al = 1,6), ΔЭО = 0,9 → ковалентная полярная связь.
Формула: Al₄C₃
Связь между атомами C и Al полярная, но не ионная. В соединении каждый углерод связывается с 4 алюминиями, образуя устойчивую структуру.







