Решебник по химии 10 класс Габриелян | Страница 70
Страница 70
Проверьте свои знания
1. Приведите молекулярную и структурную формулы фенола. Найдите черты сходства и различия в строении молекул фенола и этанола.
Молекулярная формула фенола — C₆H₅OH. Структурная формула фенола: бензольное кольцо с присоединённой к нему гидроксильной группой (—OH).
Сходства: — В обеих молекулах есть функциональная группа —OH (гидроксильная). — Оба вещества способны образовывать водородные связи. — Оба вещества проявляют слабые кислотные свойства.
Различия: — У этанола (C₂H₅OH) —OH группа связана с насыщенным (предельным) углеродом, а у фенола — с ароматическим кольцом. — У фенола более выражены кислотные свойства из-за влияния ароматического кольца. — Фенол — ароматическое соединение, этанол — алифатическое (предельное). — Из-за строения фенол не относится к спиртам в строгом смысле (он входит в отдельный класс — фенолы), и его химические свойства во многом отличаются от свойств спиртов.
2. Как взаимное влияние фенильного радикала и гидроксильной группы отражается на свойствах фенола? Ответ проиллюстрируйте уравнениями химических реакций.
Фенольная группа —OH под влиянием фенильного радикала становится более кислотной. Ароматическое кольцо (C₆H₅—) усиливает полярность связи O—H, облегчая отщепление иона H⁺. Поэтому фенол может реагировать даже с щелочами, в отличие от обычных спиртов. Примеры реакций:
Реакция с натрием (образуется фенолят натрия и водород): (C₆H₅OH + Na → C₆H₅ONa + ½H₂)
Реакция с щелочью: (C₆H₅OH + NaOH → C₆H₅ONa + H₂O)
Реакция с бромной водой — качественная реакция на фенол: (C₆H₅OH + 3Br₂ → C₆H₂Br₃OH + 3HBr)
(образуется белый осадок 2,4,6-трибромфенола)
Таким образом, взаимное влияние ароматического кольца и гидроксильной группы делает фенол более реакционноспособным, чем обычные спирты, усиливает его кислотные свойства и определяет его участие в реакциях электрофильного замещения по кольцу.
Стр. 70
Примените свои знания
3. В настоящее время вместо фенола в качестве дезинфицирующего средства используют 2,4,6-трихлорфенол. Предложите способ его получения исходя из бензола. Напишите уравнения соответствующих реакций.
Для получения 2,4,6-трихлорфенола из бензола можно использовать следующие стадии:
Нитрование бензола:
(C₆H₆ + HNO₃ → C₆H₅NO₂ + H₂O)
Восстановление нитробензола до анилина:
(C₆H₅NO₂ + 3H₂ → C₆H₅NH₂ + 2H₂O)
Диазотирование и последующее замещение на гидроксильную группу (реакция Зандмейера):
(C₆H₅NH₂ + HNO₂ + HCl → C₆H₅N₂⁺Cl⁻ + 2H₂O)
(C₆H₅N₂⁺Cl⁻ + H₂O → C₆H₅OH + N₂ + HCl)
Хлорирование фенола в избытке хлора:
(C₆H₅OH + 3Cl₂ → C₆H₂Cl₃OH + 3HCl)
Таким образом, из бензола через стадии нитрования, восстановления, диазотирования и замещения можно получить фенол, а затем — 2,4,6-трихлорфенол.
4. В результате взаимодействия 47 г водного раствора фенола с бромной водой выпало 1,655 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
Осадок, который выпадает при взаимодействии фенола с бромной водой, — это 2,4,6-трибромфенол. Его формула: C₆H₂Br₃OH. Молярная масса:
= 12×6 (углерод) + 1 (водород) + 80×3 (бром) + 16 (кислород)
= 72 + 1 + 240 + 16 = 329 г/моль
Из уравнения реакции видно, что 1 моль фенола даёт 1 моль осадка:
(C₆H₅OH + 3Br₂ → C₆H₂Br₃OH↓ + 3HBr)
Значит, из массы осадка 1,655 г находим количество вещества:
n(осадка) = 1,655 г / 329 г/моль ≈ 0,00503 моль
Следовательно, столько же моль фенола участвовало в реакции. Теперь найдём массу фенола:
m(фенола) = 0,00503 моль × 94 г/моль = 0,4728 г
Теперь найдём массовую долю:
ω = (0,4728 г / 47 г) × 100% ≈ 1,01%
Ответ: массовая доля фенола в растворе составляет примерно 1,01%.
5. В трёх пробирках без подписей находятся водные растворы пропанола-1, глицерина и фенола. С помощью каких реагентов можно определить каждый из растворов?
Для различения веществ используем следующие качественные реакции:
— Фенол можно отличить с помощью бромной воды. При добавлении к раствору фенола бромной воды выпадает белый осадок 2,4,6-трибромфенола (реакция обесцвечивает раствор).
— Глицерин (многоатомный спирт) реагирует с гидроксидом меди(II) с образованием ярко-синего раствора (комплексное соединение).
— Пропанол-1 не даёт ни осадка с бромной водой, ни окраски с Cu(OH)₂ — это одноатомный спирт, можно отличить по отсутствию реакций.
Ответ: фенол — по осадку с бромной водой; глицерин — по синему раствору с Cu(OH)₂; пропанол-1 — по отсутствию реакций.
6. Фенолят натрия взаимодействует с углекислым газом с образованием гидроксибензойной кислоты и фенола согласно уравнению
C₆H₅ONa + CO₂ + H₂O → C₆H₅OH + NaHCO₃
Какой вывод относительно кислотных свойств фенола и угольной кислоты можно сделать на основании этой реакции?
По уравнению видно, что углекислый газ вытесняет фенол из его соли (фенолята натрия). Это значит, что угольная кислота сильнее фенола, то есть имеет более выраженные кислотные свойства.
Иначе говоря, кислотность фенола ниже, чем у угольной кислоты (H₂CO₃), что и объясняет возможность обратного вытеснения фенола из соли.
Ответ: угольная кислота по сравнению с фенолом является более сильной кислотой, так как способна вытеснять фенол из его соли.
Стр. 70
Используйте дополнительную информацию
7. Опишите физические свойства фенола. Найдите в Интернете данные о растворимости фенола в воде при различных температурах. Постройте график температурной зависимости растворимости фенола в воде.
Фенол — это бесцветное кристаллическое вещество с характерным запахом. При хранении на воздухе приобретает розоватый оттенок. Имеет температуру плавления около 40 °C и температуру кипения 182 °C. Плохо растворяется в холодной воде, но его растворимость резко увеличивается при нагревании. Благодаря наличию гидроксильной группы —OH фенол способен образовывать водородные связи с молекулами воды, что объясняет его растворимость и изменение растворимости с повышением температуры.
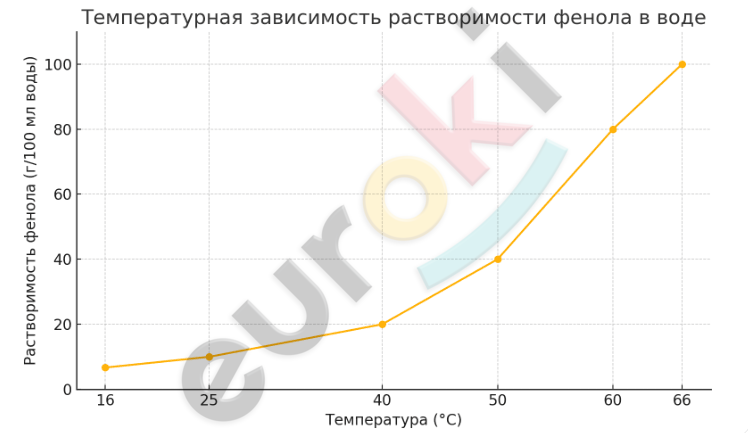
С ростом температуры растворимость фенола в воде возрастает. Ниже приведены примерные экспериментальные данные:
при 16 °C — около 6,7 г/100 мл воды
при 25 °C — около 10 г/100 мл
при 40 °C — около 20 г/100 мл
при 50 °C — около 40 г/100 мл
при 60 °C — около 80 г/100 мл
при 66 °C — около 100 г/100 мл
График температурной зависимости растворимости фенола в воде представлен выше. Из графика видно, что растворимость фенола резко увеличивается с повышением температуры, что подтверждает наличие водородных связей между его молекулами и молекулами воды.
Параграф 14. Альдегиды и кетоны
Стр. 70
Вопрос
1. В 1835 г. немецкий химик Юстус Либих выделил из смеси продуктов окисления этилового спирта неизвестное вещество. По сравнению с исходным этанолом (C₂H₆O) это соединение содержало на два атома водорода меньше (C₂H₄O). Учёный дал веществу латинское название Alkohol dehydrogenatus, или сокращённо альдегид. Попробуйте перевести на русский приведённое выше название. Какую функциональную группу содержат альдегиды и какие характерные свойства этого класса соединений она определяет?
Название Alkohol dehydrogenatus можно перевести с латинского как «обезвоженный (или дегидрированный) спирт». Это означает, что из молекулы спирта были удалены два атома водорода — один от гидроксильной группы (–OH), а другой от атома углерода, к которому она была присоединена. В результате образуется альдегид.
Альдегиды содержат функциональную группу –CHO, называемую альдегидной. Эта группа включает двойную связь углерода с кислородом (=O) и одинарную связь углерода с водородом (–H).
Функциональная альдегидная группа определяет химические свойства соединений этого класса:
высокая реакционная способность;
способность к окислению (до карбоновых кислот);
восстановительные свойства;
участие в реакциях присоединения (в частности, с водородом, спиртами, аммиаком и др.).
Альдегиды обладают также характерным запахом и применяются, например, в парфюмерии и органическом синтезе.

