Решебник по химии 10 класс Габриелян §18
§18
Амины
Стр. 93
Вопрос
1. При изучении бензола вы познакомились с одним из представителей этого класса органических соединений — анилинами, молекула которых состоит из одновалентного фенильного радикала и функциональной группы, характерной для аминов. Вспомните формулу анилина и предложите общую формулу для аминов. Можно ли рассматривать их как продукты замещения атомов водорода в молекуле аммиака углеводородными радикалами?
Анилин — это ароматический амин, его молекула состоит из бензольного кольца (фенильного радикала C₆H₅–) и аминогруппы (–NH₂). Химическая формула анилина: C₆H₅NH₂.
Общая формула аминов может быть представлена как производная аммиака (NH₃), в которой один, два или три атома водорода заменены углеводородными радикалами (алкильными или арильными). Таким образом, общая формула аминов:
Первичные амины: R–NH₂
Вторичные амины: R₂NH
Третичные амины: R₃N
Где R — углеводородный радикал (например, метил, этил, фенил и др.).
Да, амины можно рассматривать как продукты замещения атомов водорода в молекуле аммиака на углеводородные радикалы. Это основа их классификации и химической природы. Анилин как раз является примером первичного ароматического амина, в котором один атом водорода в NH₃ замещён на фенильную группу.
Стр. 98
Проверьте свои знания
1. Какие вещества называют аминами? Как классифицируют амины по природе углеводородного радикала?
Аминами называют органические вещества, в молекулах которых углеводородный радикал связан с аминогруппой —NH₂. По сути, амины являются производными аммиака (NH₃), в которых один или несколько атомов водорода замещены углеводородными радикалами. Эти соединения играют важную роль в органической химии, биохимии, медицине и промышленности.
Амины классифицируют по числу замещённых атомов водорода в молекуле аммиака:
Первичные амины — один атом водорода замещён: R–NH₂ (например, метиламин CH₃–NH₂)
Вторичные амины — два атома водорода замещены: R₂NH
Третичные амины — все три атома водорода замещены: R₃N
Кроме того, амины делят по природе радикала:
Предельные (алифатические) амины, если радикал R представляет собой алкильную группу (например, этил, пропил);
Ароматические амины, если радикал R — это арильная группа (например, фенил — C₆H₅). Пример: анилин C₆H₅–NH₂.
2. Амины называют органическими основаниями. Почему? Напишите уравнения реакций, подтверждающих эту характеристику. Сравните основные свойства аммиака, метиламина и анилина.
Амины называют органическими основаниями, потому что они, как и аммиак, способны присоединять протон (ион водорода H⁺), проявляя основные свойства. Это объясняется наличием неподелённой электронной пары на атоме азота в аминогруппе —NH₂, которая может связывать H⁺, образуя ионное соединение.
Примеры реакций с кислотами:
Аммиак: (NH₃ + HCl → NH₄Cl)
Метиламин: (CH₃NH₂ + HCl → CH₃NH₃Cl)
Анилин: (C₆H₅NH₂ + HCl → C₆H₅NH₃Cl)
Сравнение:
Аммиак — бесцветный газ с резким запахом, хорошо растворяется в воде, даёт щелочную реакцию.
Метиламин — бесцветный газ с запахом аммиака, растворим в воде, обладает выраженной основностью.
Анилин — бесцветная жидкость (на воздухе буреет), плохо растворяется в воде, является слабым основанием, проявляет основные свойства слабее, чем аммиак и метиламин, из-за влияния ароматического кольца.
Таким образом, основность аминов зависит от структуры радикала: у метиламина основность выше, у анилина — ниже.
3. На примере молекулы анилина рассмотрите третье положение теории химического строения органических соединений о взаимном влиянии атомов в молекулах. Ответ подтвердите уравнениями химических реакций.
Третье положение теории химического строения гласит, что атомы в молекуле органического соединения взаимно влияют друг на друга. Это отчётливо проявляется в молекуле анилина (C₆H₅–NH₂).
В анилине аминогруппа —NH₂ связана с бензольным кольцом. Электронная плотность аминогруппы смещается в ароматическую систему, активируя её и усиливая реакционную способность при электрофильном замещении, особенно в положениях 2 и 4 по отношению к аминогруппе.
Это подтверждается реакцией бромирования:
(C₆H₅NH₂ + 3Br₂ → C₆H₂Br₃NH₂ + 3HBr)
Продукт реакции — 2,4,6-триброманилин — представляет собой осадок белого цвета, образующийся без катализатора (в отличие от бензола). Это означает, что аминогруппа влияет на реакционную способность всего кольца.
Таким образом, влияние аминогруппы на бензольное кольцо и его повышенная реакционная способность в определённых положениях служат примером взаимного влияния атомов в молекуле, как описано в третьем положении теории химического строения органических соединений.
Стр. 98
Примените свои знания
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: хлороформ → метанол → метиламин → бромид метиламмония
Хлорметан → метанол
CH₃Cl + NaOH → CH₃OH + NaCl
(гидролиз хлорметана водным раствором щёлочи)
Метанол → метиламин
CH₃OH + NH₃ → CH₃NH₂ + H₂O
(взаимодействие метанола с аммиаком при нагревании и наличии катализатора)
Метиламин → бромид метиламмония
CH₃NH₂ + HBr → [CH₃NH₄]Br
(взаимодействие метиламина с бромистоводородной кислотой)
5. Смешали 10 л газообразного метиламина (при н. у.) и 10 л хлороводорода. Какая масса кристаллического хлорида метиламмония при этом образовалась? Какой газ и в каком объёме остался в колбе после окончания реакции?
Уравнение реакции:
CH₃NH₂ + HCl → CH₃NH₃Cl
Из уравнения видно, что вещества вступают в реакцию в равных объёмах (1:1), поэтому при 10 л CH₃NH₂ и 10 л HCl оба газа прореагируют полностью. Остатков не будет, и в колбе не останется газа, только твёрдый продукт — хлорид метиламмония.
Найдём массу образовавшегося соединения:
1 моль любого газа при н. у. = 22,4 л
10 л = 10 / 22,4 ≈ 0,446 моль
Молярная масса CH₃NH₃Cl = 12 + 3×1 + 14 + 3×1 + 35,5 = 67,5 г/моль
Масса соли:
m = 0,446 моль × 67,5 г/моль ≈ 30,1 г
Ответ: Образовалось 30,1 г хлорида метиламмония, газа в колбе не осталось.
6. При сжигании органического вещества образовалось 1,26 г воды, 0,896 л оксида углерода (IV) и 0,224 л азота (н. у.). Найдите молекулярную формулу этого вещества.
Найдём количество молей каждого вещества:
H₂O: M(H₂O) = 18 г/моль → n(H₂O) = 1,26 / 18 = 0,07 моль
CO₂: 0,896 л / 22,4 = 0,04 моль
N₂: 0,224 л / 22,4 = 0,01 моль
Найдём атомное соотношение:
H: в 1 молекуле воды — 2 атома → 0,07 × 2 = 0,14 моль атомов H
C: каждый CO₂ — 1 атом C → 0,04 моль
N: в молекуле N₂ — 2 атома, значит: 0,01 × 2 = 0,02 моль атомов N
Отношение:
C : H : N = 0,04 : 0,14 : 0,02
→ делим на наименьшее (0,02):
C = 2, H = 7, N = 1
Эмпирическая формула: C₂H₇N
Молярная масса C₂H₇N = 2×12 + 7×1 + 14 = 45 г/моль
Если это соответствует молекулярной массе, то молекулярная формула: C₂H₇N (например, этилметиламин или диметиламин).
Стр. 98
Используйте дополнительную информацию
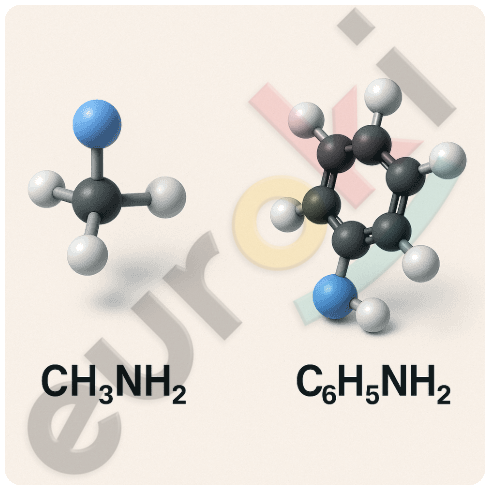
7. Создайте компьютерные 3D-модели молекул метиламина и анилина. Рассмотрите взаимное расположение атомов и атомных групп относительно атома азота.
При создании и рассмотрении 3D-моделей молекул метиламина (CH₃NH₂) и анилина (C₆H₅NH₂) можно заметить следующее:
Метиламин:
Молекула состоит из метильной группы (CH₃–), связанной с аминогруппой (–NH₂).
-
Атом азота имеет пирамидальную форму (как и в молекуле аммиака), к нему присоединены:
один атом углерода (от CH₃-группы),
два атома водорода,
и остаётся одна неподелённая электронная пара.
Углы между связями составляют около 107°, что характерно для sp³-гибридизации.
Анилин:
Молекула состоит из бензольного кольца (C₆H₅–), связанного с аминогруппой (–NH₂).
Аминогруппа находится в плоскости кольца, а её электронная пара может частично делокализоваться на π-систему ароматического кольца.
Поэтому геометрия атома азота в анилине менее выраженно пирамидальная, ближе к плоской (между sp² и sp³-гибридизацией), с меньшими углами между связями (~120°).
Сравнение:
У метиламина структура ближе к идеальной пирамиде (sp³).
У анилина плоская структура, и частичная сопряжённость аминогруппы с кольцом влияет на углы и форму — это делает молекулу более «сплюснутой» у атома азота.
Такое различие влияет на химические свойства: аминогруппа анилина менее активно взаимодействует с кислотами, чем аминогруппа метиламина.
Таким образом, 3D-модели наглядно демонстрируют взаимное расположение атомов и влияние сопряжения на строение молекулы.
8. Подготовьте сообщение на тему «История и современность анилинокрасочной промышленности».
История и современность анилинокрасочной промышленности
Анилинокрасочная промышленность — одна из важнейших отраслей химии органических соединений, стоявшая у истоков современной химической индустрии. Она сыграла огромную роль в развитии технологий синтеза, медицины, текстильной промышленности и многих других сфер.
История этой отрасли началась в середине XIX века. В 1856 году английский студент Уильям Генри Перкин, пытаясь синтезировать хинин (лекарство от малярии), случайно получил вещество фиолетового цвета. Это вещество оказалось способным окрашивать ткани и стало первым в истории синтетическим красителем. Его назвали мовы́н (mauveine) или анилиновый фиолетовый. Перкин не только открыл новое вещество, но и организовал его промышленное производство, положив начало анилинокрасочной промышленности.
Название «анилин» происходит от слова «anil», которое использовали в Индии для обозначения индиго — одного из самых древних природных красителей. Сам анилин (C₆H₅NH₂) — это ароматическое соединение, производное бензола, содержащее аминогруппу. Благодаря своей химической активности он стал основой для получения множества красителей различных цветов: фиолетовых, розовых, красных, синих и зелёных.
В XIX веке анилинокрасочная промышленность получила стремительное развитие в Великобритании, Франции и Германии. Особенно большую роль сыграла Германия, где были основаны такие известные компании, как BASF, Bayer и Hoechst. Немецкие химики синтезировали десятки новых красителей, многие из которых использовались в текстильной и кожевенной промышленности.
С течением времени стало понятно, что на основе анилина можно производить не только красители, но и лекарственные препараты (например, сульфаниламидные антибиотики), взрывчатые вещества (тринитротолуол), гербициды, полимеры (полиуретаны) и другие ценные вещества. Таким образом, анилинокрасочная отрасль переросла границы одного направления и стала фундаментом для развития органического синтеза в целом.
В XX веке анилинокрасочная промышленность значительно модернизировалась. Производства стали более безопасными и экологичными, активно внедрялись автоматизированные процессы, улучшались методы очистки стоков и утилизации отходов. Помимо текстиля, анилиновые красители начали использоваться в производстве пластмасс, резины, бумаги, косметики, а также в микробиологии (например, метиленовый синий).
В наши дни ведущими производителями анилиновых красителей и их производных остаются крупные международные химические концерны: BASF, Bayer, Clariant, Huntsman и другие. В России также функционируют предприятия, выпускающие красители для тканей, бумаги, кожи и пищевой промышленности. Кроме того, продолжаются научные исследования по созданию более стойких, безопасных и универсальных красителей с использованием нанотехнологий и экологически чистых процессов.
Таким образом, история анилинокрасочной промышленности — это пример того, как одно случайное открытие может привести к созданию целой отрасли, оказывающей влияние на повседневную жизнь миллионов людей. Современное состояние отрасли показывает, что она продолжает развиваться, сочетая достижения классической химии с передовыми технологиями XXI века.

