Вопрос:
Опыт 1. Получение жесткой воды В пробирку с кусочками карбоната кальция СаСОз прилейте 2-3 мл раствора соляной кислоты НСІ. Пробирку закройте пробкой с газоотводной трубкой. Что происходит в пробирке? Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде. Конец газоотводной трубки, из которой выделяется углекислый газ СО2, опустите в пробирку с 2 мл известковой воды (прозрачный раствор Са(ОН)2). Что происходит в пробирке с известковой водой? Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде. Продолжайте пропускать углекислый газ до получения прозрачной жидкости. Полученную жесткую воду разделите на две пробирки. Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде.
Ответ:
В пробирке с карбонатом кальция и соляной кислотой происходит реакция с выделением углекислого газа, что и наблюдается.
Уравнение реакции в молекулярном виде:
$CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2$
Уравнение реакции в ионном виде:
$Ca^{2+} + CO_3^{2-} + 2H^+ + 2Cl^- \rightarrow Ca^{2+} + 2Cl^- + H_2O + CO_2$
Уравнение реакции в сокращенном ионном виде:
$CO_3^{2-} + 2H^+ \rightarrow H_2O + CO_2$
При пропускании углекислого газа через известковую воду (гидроксид кальция) происходит помутнение раствора из-за образования нерастворимого карбоната кальция:
Уравнение реакции в молекулярном виде:
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3 + H_2O$
Уравнение реакции в ионном виде:
$Ca^{2+} + 2OH^- + CO_2 \rightarrow CaCO_3 + H_2O$
Уравнение реакции в сокращенном ионном виде:
$Ca^{2+} + 2OH^- + CO_2 \rightarrow CaCO_3 + H_2O$
При дальнейшем пропускании углекислого газа осадок растворяется из-за образования растворимого гидрокарбоната кальция:
$CaCO_3 + CO_2 + H_2O \rightarrow Ca(HCO_3)_2$
Уравнение реакции в ионном виде:
$CaCO_3 + CO_2 + H_2O \rightarrow Ca^{2+} + 2HCO_3^-$
Похожие
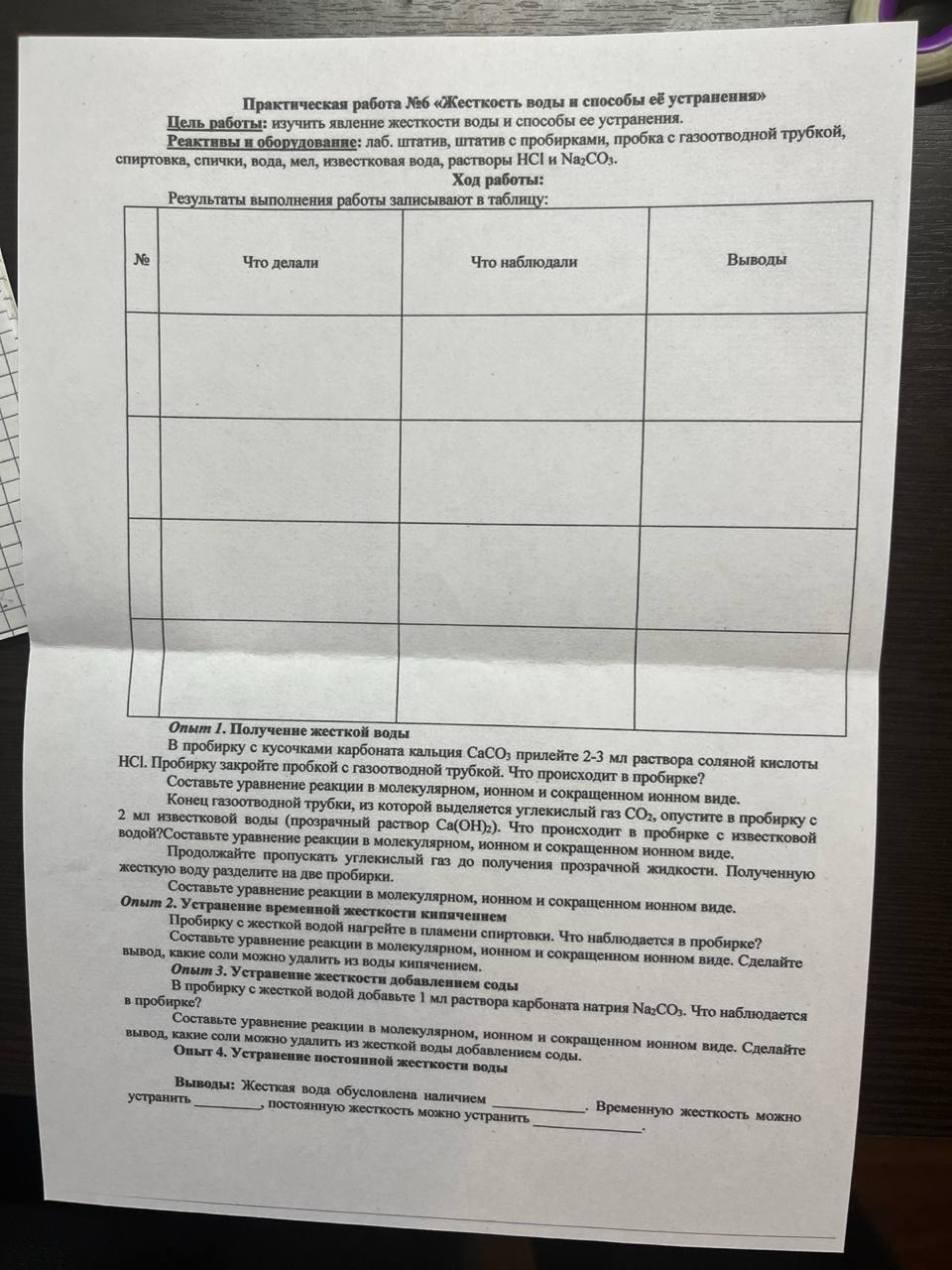
- Практическая работа №6 «Жесткость воды и способы её устранения» Цель работы: изучить явление жесткости воды и способы ее устранения. Реактивы и оборудование: лаб. штатив, штатив с пробирками, пробка с газоотводной трубкой, спиртовка, спички, вода, мел, известковая вода, растворы НСІ и Na2CO3. Ход работы: Результаты выполнения работы записывают в таблицу: № Что делали Что наблюдали Выводы
- Опыт 1. Получение жесткой воды В пробирку с кусочками карбоната кальция СаСОз прилейте 2-3 мл раствора соляной кислоты НСІ. Пробирку закройте пробкой с газоотводной трубкой. Что происходит в пробирке? Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде. Конец газоотводной трубки, из которой выделяется углекислый газ СО2, опустите в пробирку с 2 мл известковой воды (прозрачный раствор Са(ОН)2). Что происходит в пробирке с известковой водой? Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде. Продолжайте пропускать углекислый газ до получения прозрачной жидкости. Полученную жесткую воду разделите на две пробирки. Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде.
- Опыт 2. Устранение временной жесткости кипячением Пробирку с жесткой водой нагрейте в пламени спиртовки. Что наблюдается в пробирке? Составьте уравнение реакции в молекулярном, ионном и сокращенном нонном виде. Сделайте вывод, какие соли можно удалить из воды кипячением.
- Опыт 3. Устранение жесткости добавлением соды В пробирку с жесткой водой добавьте 1 мл раствора карбоната натрия Na2CO3. Что наблюдается в пробирке? Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде. Сделайте вывод, какие соли можно удалить из жесткой воды добавлением соды.
- Опыт 4. Устранение постоянной жесткости воды Выводы: Жесткая вода обусловлена наличием __________ . Временную жесткость можно ___________, постоянную жесткость можно устранить ___________