Решебник по химии 9 класс. Рудзитис ФГОС §54
§54
Железо
Стр. 202
Вопросы
1. Чем различается строение атомов элементов A- и B-групп?
Атомы элементов A-групп (главные подгруппы) имеют внешние электроны только на s- и p-орбиталях, а валентные электроны располагаются на самом внешнем энергетическом уровне. Их строение проще, и количество электронов на внешнем уровне совпадает с номером группы. Например, у магния (Mg), элемента IIA-группы, два электрона на внешнем уровне.
Атомы элементов B-групп (побочные подгруппы) содержат d-электроны, которые относятся к предпоследнему уровню. У них внешние s-электроны могут участвовать в реакциях, но также участвуют d-электроны, поэтому возможны переменные степени окисления. Например, у железа (Fe) степень окисления может быть +2 и +3. Это делает химию переходных металлов более сложной.
2. Какие способы получения металлов вам известны?
Существуют несколько основных способов получения металлов:
Восстановление из оксидов — наиболее распространённый способ. Используют углерод (в виде кокса), водород или другие металлы. Например: (Fe₂O₃ + 3CO → 2Fe + 3CO₂)
Электролиз — применяется для получения активных металлов (натрий, кальций, алюминий) из расплавов их солей: (2NaCl → 2Na + Cl₂↑)
Металлотермическое восстановление — восстановление менее активных металлов более активными (например, алюминий восстанавливает железо): (Fe₂O₃ + 2Al → 2Fe + Al₂O₃)
Термолиз некоторых солей, например, разложение карбонатов или гидроксидов, приводит к образованию оксидов, которые затем восстанавливают.
Выбор способа зависит от активности металла и его положения в ряду напряжений.
Стр. 204
Подумай, ответь, выполни
1. В каком виде железо встречается в природе? Напишите формулы соединений и дайте им названия.
Железо в природе встречается только в виде соединений, в составе различных минералов. Основные природные соединения железа:
– Магнетит (магнитный железняк): Fe₃O₄
– Гематит (красный железняк): Fe₂O₃
– Лимонит (бурый железняк): Fe₂O₃·nH₂O
– Пирит (серный колчедан): FeS₂
– Сидерит (железный шпат): FeCO₃
Эти соединения служат сырьём для получения металлического железа и применяются в металлургии.
2. Составьте уравнения реакций, в которых железо реагирует: а) с кислотами; б) с солями; в) с водой при повышенной температуре. Покажите переход электронов и укажите окислитель и восстановитель.
а) С кислотами:
(Fe + 2HCl → FeCl₂ + H₂↑)
Железо (0) → Fe²⁺ + 2e⁻ (восстановитель)
2H⁺ + 2e⁻ → H₂ (окислитель — ионы водорода)
б) С солями (реакция замещения):
(Fe + CuSO₄ → FeSO₄ + Cu)
Fe⁰ → Fe²⁺ + 2e⁻ (восстановитель)
Cu²⁺ + 2e⁻ → Cu⁰ (окислитель — медь)
в) С водой при нагревании:
(3Fe + 4H₂O → Fe₃O₄ + 4H₂↑)
Fe⁰ → Fe³⁺, H₂O → H₂
Окислитель — вода, восстановитель — железо.
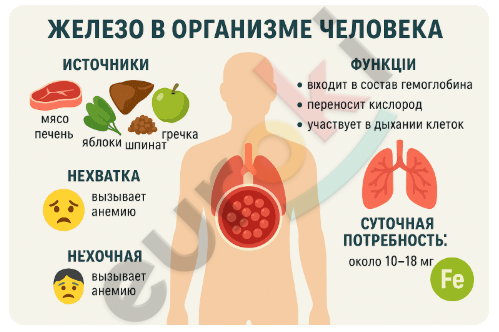
3. Используя знания по биологии, Интернет и дополнительную литературу, составьте инфографику о роли элемента железа в организме человека.
Железо — жизненно важный микроэлемент. Оно входит в состав гемоглобина — белка, переносящего кислород в крови. Также железо содержится в миоглобине (в мышцах), ферментах дыхательной цепи и некоторых других белках. Недостаток железа вызывает анемию. Суточная потребность — около 10–18 мг. Источники: мясо, печень, яблоки, гречка, шпинат.
4. Минеральная вода некоторых источников содержит гидрокарбонат железа(II). При каких условиях и в каких химических процессах эта растворимая соль железа может образоваться из природного минерала сидерита FeCO₃?
Сидерит (FeCO₃) может взаимодействовать с углекислым газом и водой, особенно при повышенном давлении, образуя гидрокарбонат железа(II), который хорошо растворим в воде:
(FeCO₃ + CO₂ + H₂O → Fe(HCO₃)₂)
Такая реакция возможна в подземных водах, насыщенных CO₂. При выходе воды на поверхность и снижении давления CO₂ выделяется, и гидрокарбонат разлагается обратно на FeCO₃ и CO₂. Поэтому в минеральной воде он встречается в нестойкой форме.
Стр. 204
Тестовые задания
1. Схема строения иона Fe³⁺ — это
+26 ) ) ) ) 2 8 14 2
+26 ) ) ) ) 2 8 13
+26 ) ) ) ) 2 8 15
+27 ) ) ) ) 2 8 15 2
Ответ: 2) +26 ) ) ) ) 2 8 13
Обоснование: У атома железа (Fe) порядковый номер 26, значит в нейтральном состоянии у него 26 электронов. В ионе Fe³⁺ отняты 3 электрона — остаётся 23 электрона. Электронная конфигурация: 2 (K-слой), 8 (L-слой), 13 (M-слой).
2. Степень окисления железа в Fe₂(SO₄)₃ равна
+2
+3
+4
+8
Ответ: 2) +3
Обоснование: Сульфат-ион (SO₄²⁻) имеет заряд –2. В молекуле три иона SO₄²⁻ → общий заряд –6. Чтобы соединение было нейтральным, два атома железа должны суммарно давать +6. Следовательно, на каждый атом железа приходится степень окисления +3.
3. Металл, который при нагревании реагирует с водой, — это
медь
железо
олово
свинец
Ответ: 2) железо
Обоснование: При нагревании железо взаимодействует с водяным паром:
(3Fe + 4H₂O → Fe₃O₄ + 4H₂↑)
Медь и свинец не взаимодействуют с водой даже при высоких температурах. Олово — очень слабо. Поэтому правильный ответ — железо.






