Решебник по химии 9 класс. Рудзитис ФГОС §52
§52
Алюминий
Стр. 195
Вопросы
1. Какие области использования алюминия вам известны из повседневной жизни?
Алюминий широко используется в нашей повседневной жизни. Из него делают упаковки для продуктов — фольгу, банки для напитков, пищевые контейнеры. Алюминий применяют в строительстве для изготовления оконных рам, сайдинга, крыш. Он входит в состав корпусов автомобилей, велосипедов, самолётов благодаря своей лёгкости. Также алюминиевую посуду можно встретить на кухне — кастрюли, сковородки, противни. Электропровода часто делают из алюминия, потому что он хорошо проводит ток и дешевле меди.
2. Какие элементы находятся в IIIА-группе Периодической системы?
В IIIА-группе (13 группе по современной нумерации) Периодической системы находятся следующие элементы:
— Бор (B)
— Алюминий (Al)
— Галлий (Ga)
— Индий (In)
— Таллий (Tl)
— Нихоний (Nh)
Эти элементы имеют по три электрона на внешнем энергетическом уровне и часто проявляют степень окисления +3.
Стр. 197
Подумай, ответь, выполни
1. Пользуясь периодической таблицей и на основе представлений о строении атомов, поясните, как изменяются свойства элементов в ряду Na — Mg — Al.
В ряду Na → Mg → Al увеличивается заряд ядра и число электронов. У натрия на внешнем уровне 1 электрон, у магния — 2, у алюминия — 3. Радиус атома уменьшается, так как возрастает притяжение к ядру. Металлические свойства уменьшаются, так как с увеличением числа внешних электронов труднее отдать все электроны. Поэтому уменьшается восстановительная способность: натрий — самый активный, алюминий — менее активный. Увеличивается степень окисления: у Na — +1, у Mg — +2, у Al — +3.
2. Почему алюминий в природе встречается только в соединениях?
Алюминий — очень активный металл, он находится в ряду напряжений почти в начале, уступая только щелочным и щелочноземельным металлам. Он легко соединяется с кислородом, серой, кислотами и водой. Поэтому в природе он существует только в виде устойчивых соединений, таких как оксиды, гидроксиды и силикаты. Например, боксит, каолинит, нефелин и корунд. Энергетически выгоднее находиться алюминию в связанном виде, чем в свободном.
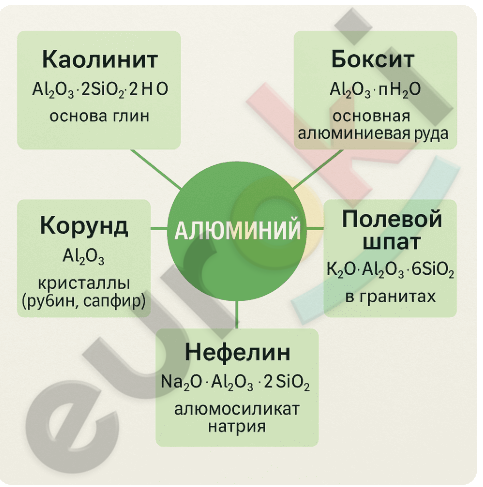
3. Составьте инфографику о природных соединениях алюминия.
Инфографика может содержать центральный элемент «Алюминий», от которого отходят стрелки к основным соединениям:
Каолинит: Al₂O₃·2SiO₂·2H₂O — основа глин.
Боксит: Al₂O₃·nH₂O — основная алюминиевая руда.
Корунд: Al₂O₃ — кристаллы (рубин, сапфир).
Полевой шпат: K₂O·Al₂O₃·6SiO₂ — в гранитах.
Нефелин: Na₂O·Al₂O₃·2SiO₂ — алюмосиликат натрия.
4. Для получения алюминия из AlCl₃ в качестве восстановителя можно использовать кальций. Охарактеризуйте этот процесс и составьте уравнение реакции, покажите переход электронов. Почему эту реакцию нельзя проводить в водном растворе?
Реакция восстановления алюминия из его соединения — это процесс восстановления Al³⁺ до Al⁰. Кальций — активный металл, имеет более высокую восстановительную способность, чем алюминий, и способен вытеснить его:
(3Ca + 2AlCl₃ → 3CaCl₂ + 2Al)
Переход электронов:
Ca⁰ → Ca²⁺ + 2e⁻ (восстановитель)
Al³⁺ + 3e⁻ → Al⁰ (восстанавливается)
Реакцию нельзя проводить в водном растворе, потому что кальций будет реагировать с водой:
(Ca + 2H₂O → Ca(OH)₂ + H₂↑)
5. Составьте уравнения реакций, в которых алюминий восстанавливает: а) галогены; б) железо; в) ионы водорода; г) серу; д) кислород. Покажите переход электронов.
а) С галогенами:
(2Al + 3Cl₂ → 2AlCl₃)
Al⁰ → Al³⁺ + 3e⁻
Cl₂⁰ + 2e⁻ → 2Cl⁻
б) С оксидом железа:
(2Al + Fe₂O₃ → Al₂O₃ + 2Fe)
Al⁰ → Al³⁺
Fe³⁺ → Fe⁰
в) С кислотой (ионы водорода):
(2Al + 6HCl → 2AlCl₃ + 3H₂↑)
Al⁰ → Al³⁺
H⁺ + e⁻ → H₂↑
г) С серой:
(2Al + 3S → Al₂S₃)
Al⁰ → Al³⁺
S⁰ + 2e⁻ → S²⁻
д) С кислородом:
(4Al + 3O₂ → 2Al₂O₃)
Al⁰ → Al³⁺
O₂⁰ + 4e⁻ → 2O²⁻
Во всех реакциях алюминий — восстановитель, он отдаёт электроны, снижая степень окисления других веществ.
6. Могут ли быть окислителями: а) атомы алюминия; б) ионы алюминия? Ответ подтвердите уравнениями реакций.
а) Атомы алюминия не могут быть окислителями, так как они находятся в нулевой степени окисления и, наоборот, отдают электроны, переходя в ионы Al³⁺. Пример:
(2Al + 6HCl → 2AlCl₃ + 3H₂↑) — алюминий восстанавливает ионы водорода, сам окисляется.
б) Ионы алюминия Al³⁺ могут быть окислителями, так как они принимают электроны и восстанавливаются до атомов алюминия:
(3Mg + 2AlCl₃ → 2Al + 3MgCl₂)
Al³⁺ + 3e⁻ → Al⁰ — восстановление алюминия, значит, Al³⁺ выступает как окислитель.
7. Сколько потребуется алюминия, чтобы при реакции с соляной кислотой получить столько водорода, сколько его выделяется при взаимодействии 1 моль натрия с водой?
Уравнение реакции натрия с водой:
(2Na + 2H₂O → 2NaOH + H₂↑)
Из 2 моль Na выделяется 1 моль H₂, значит, из 1 моль Na — 0,5 моль H₂.
Уравнение реакции алюминия с HCl:
(2Al + 6HCl → 2AlCl₃ + 3H₂↑)
Из 2 моль Al выделяется 3 моль H₂. Тогда на 0,5 моль H₂ нужно:
(2 моль Al / 3 моль H₂) × 0,5 моль H₂ = 1/3 моль Al
Mr(Al) = 27 г/моль
m = 27 × 1/3 = 9 г
Ответ: потребуется 9 г алюминия.
8. На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л некоторого газа (н. у.). Вычислите процентный состав сплава, если его общая масса была 10 г.
Газ — это водород (H₂), выделяющийся при реакции алюминия с щелочью:
(2Al + 2NaOH + 6H₂O → 2Na[Al(OH)₄] + 3H₂↑)
1 моль H₂ = 22,4 л при н. у., значит:
n(H₂) = 2,24 л / 22,4 л/моль = 0,1 моль
Из уравнения: 3 моль H₂ получается из 2 моль Al, значит:
n(Al) = (2/3) × 0,1 = 0,0667 моль
m(Al) = 0,0667 × 27 = 1,8 г
Масса меди в сплаве:
10 г − 1,8 г = 8,2 г
Процентный состав:
ω(Al) = (1,8 / 10) × 100% = 18%
ω(Cu) = (8,2 / 10) × 100% = 82%
Ответ: сплав содержит 18% алюминия и 82% меди.
Стр. 198
Тестовые задания
1. Схема строения иона Al³⁺ — это
(+13) ) 2 ) 8 ) 3 )
(+13) ) 2 ) 8 )
(+8) ) 2 ) 8 )
(+12) ) 2 ) 8 )
Правильный вариант — 2).
Ион Al³⁺ образуется из атома алюминия (13Al), который имеет конфигурацию 2e, 8e, 3e. Потеряв 3 электрона, он становится ионом с конфигурацией 2e, 8e и зарядом +3.
Схема: (+13) ) 2 ) 8 )
2. Один из способов получения металлов, например, по уравнению реакции
Fe₂O₃ + 2Al = Al₂O₃ + 2Fe называют…
Этот способ получения металлов называется термитной реакцией или восстановлением алюминием.
Алюминий вытесняет менее активный металл (железо) из его оксида. Такая реакция сопровождается выделением большого количества тепла и используется, например, в термитной сварке рельсов.
3. Химическую реакцию, уравнение которой 2Al + 6HCl = 2AlCl₃ + 3H₂↑ относят к реакциям
соединения
разложения
обмена
замещения
Правильный вариант — 4) замещения.
Это реакция, в которой металл (алюминий) замещает водород в кислоте, образуя соль (AlCl₃) и водород. Подобные реакции относятся к реакциям замещения.






