Решебник по химии 8 класс. Рудзитис ФГОС §58
§58
Основные виды химической связи
Вопросы
1. Какие частицы называют ионами? Как они образуются?
Ионами называют электрически заряженные частицы, которые образуются из атомов при потере или присоединении электронов. Если атом отдаёт один или несколько электронов, он превращается в положительно заряженную частицу — катион. Если атом принимает один или несколько электронов, он становится отрицательно заряженной частицей — анионом.
Примеры:
Na⁰ → Na⁺ + e⁻ — образование катиона натрия
Cl⁰ + e⁻ → Cl⁻ — образование аниона хлора
2. Какие ионы называют катионами, а какие — анионами?
Катионами называют положительно заряженные ионы, которые образуются, когда атом отдаёт один или несколько электронов. Чаще всего катионы образуют металлы (например, Na⁺, Ca²⁺, Al³⁺).
Анионами называют отрицательно заряженные ионы, которые возникают, когда атом принимает один или несколько электронов. Анионы обычно образуются из неметаллов (например, Cl⁻, O²⁻, N³⁻).
3. Что такое валентность?
Валентность — это способность атома химического элемента образовывать определённое количество химических связей с другими атомами. Она определяется числом электронов, которые атом может отдать, принять или разделить с другим атомом при образовании соединений.
Пример: водород в H₂O имеет валентность I, кислород — II; в молекуле CH₄ углерод — IV, водород — I.
Валентность может быть постоянной (например, у водорода всегда I), или переменной (например, у серы: II, IV, VI).
Стр. 210
Подумай, ответь, выполни
1. Объясните, почему численные значения электроотрицательности атомов элементов позволяют судить о виде химической связи, возникающей между ними. Приведите примеры.
Электроотрицательность — это способность атома притягивать к себе общие электронные пары. Зная численные значения электроотрицательности, можно определить, как распределяется электронная пара между атомами в соединении.
Если электроотрицательности атомов одинаковы или очень близки (разность ΔЭО < 0,4), связь считается ковалентной неполярной, например, в молекуле водорода (H₂) или хлора (Cl₂).
Если разность значений электроотрицательности составляет от 0,4 до 1,7, образуется ковалентная полярная связь — например, в молекулах воды (H₂O), аммиака (NH₃), хлороводорода (HCl).
Если же разность значений велика (больше 1,7), связь становится ионной, например, в соединениях NaCl, KF.
Таким образом, зная значения электроотрицательности, можно заранее предсказать тип химической связи между атомами
2. В тетрадях напишите по три формулы соединений: а) с ионной; б) с ковалентной полярной; в) с ковалентной неполярной связью. Изобразите их электронные формулы.
а) С ионной связью:
NaCl → [Na]⁺ + [Cl]⁻
KBr → [K]⁺ + [Br]⁻
CaF₂ → [Ca]²⁺ + 2[F]⁻
б) С ковалентной полярной связью:
HCl → H:Cl
H₂O → H:O:H
NH₃ → N:H₃
в) С ковалентной неполярной связью:
H₂ → H:H
Cl₂ → Cl:Cl
O₂ → O::O
(Точки обозначают электронные пары. В электронных формулах, например для воды:
O (6 электронов) + 2 H (по 1) образуют две общие пары, и у кислорода остаются 2 не поделенные пары.)
3. Изобразите структурные формулы молекул воды и хлороводорода.

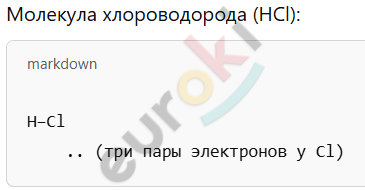
4. Учитывая значения электроотрицательностей элементов (см. табл. 19), составьте химические формулы и укажите свяжи общих электронных пар в соединениях: а) лития с азотом; б) кислорода с фтором; в) углерода с серой; г) углерода с алюминием.
а) Литий (Li = 1,0), азот (N = 3,0), ΔЭО = 2,0 → ионная связь.
Формула: Li₃N
Li отдаёт 1 электрон, N принимает 3 → 3Li⁺ + N³⁻
б) Кислород (O = 3,5), фтор (F = 4,0), ΔЭО = 0,5 → ковалентная полярная связь.
Формула: OF₂
Кислород образует 2 связи с фтором, у каждого фтора по 1 общей паре электронов с кислородом.
в) Углерод (C = 2,5), сера (S = 2,5), ΔЭО = 0 → ковалентная неполярная связь.
Формула: CS₂
C — 4 валентных электрона, S — 6. Углерод образует по 2 двойные связи с каждой серой.
г) Углерод (C = 2,5), алюминий (Al = 1,6), ΔЭО = 0,9 → ковалентная полярная связь.
Формула: Al₄C₃
Связь между атомами C и Al полярная, но не ионная. В соединении каждый углерод связывается с 4 алюминиями, образуя устойчивую структуру.
Стр. 214







