Решебник по химии 8 класс Габриелян | Страница 41
Страница 41
Проверьте свои знания
1. Что представляет собой химическая формула? Чем различаются индексы и коэффициенты?
Химическая формула – это обозначение состава вещества с помощью символов химических элементов и индексов. Она показывает, какие элементы входят в состав вещества и в каких количественных соотношениях. В химической формуле используются индексы – маленькие цифры, записанные справа внизу от символа элемента. Индексы указывают число атомов данного элемента в молекуле или формульной единице вещества. Например, в формуле воды H₂O индекс 2 означает, что в молекуле содержится два атома водорода. Коэффициенты, в отличие от индексов, ставятся перед формулой вещества и показывают число молекул. Например, запись 5CO₂ означает пять молекул углекислого газа. Таким образом, индексы указывают число атомов в одной молекуле, а коэффициенты – число молекул в уравнениях реакций.
2. Что называют относительной атомной массой и относительной молекулярной массой?
Относительная атомная масса – это величина, показывающая, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода-12. Она обозначается Aᵣ и не имеет единиц измерения, так как является относительной величиной. Например, для кислорода Aᵣ(O) = 16, а для углерода Aᵣ(C) = 12.
Относительная молекулярная масса – это сумма относительных атомных масс всех атомов, входящих в состав молекулы вещества. Она обозначается Mᵣ и рассчитывается путем сложения Aᵣ элементов с учетом их индексов. Например, для углекислого газа:
Mᵣ(CO₂) = Aᵣ(C) + 2 × Aᵣ(O) = 12 + 2 × 16 = 44
Эта величина важна для расчета масс веществ в химических реакциях и определения массовых долей элементов в сложных соединениях.
3. Какую информацию несёт химическая формула?
Химическая формула несёт несколько важных видов информации о веществе. Во-первых, она указывает, из каких элементов состоит данное вещество, то есть определяет его качественный состав. Во-вторых, химическая формула показывает количественное соотношение атомов в молекуле или формульной единице, то есть сколько атомов каждого элемента содержится в соединении. Например, формула серной кислоты H₂SO₄ говорит о том, что в её составе два атома водорода, один атом серы и четыре атома кислорода.
В-третьих, химическая формула помогает вычислять относительную молекулярную массу соединения, а также массовые доли элементов в составе вещества. Например, для сернистого газа:
Mᵣ(SO₂) = Aᵣ(S) + 2 × Aᵣ(O) = 32 + 2 × 16 = 64
Далее можно рассчитать массовые доли элементов:
w(S) = (Aᵣ(S) ÷ Mᵣ(SO₂)) × 100% = (32 ÷ 64) × 100% = 50%
w(O) = (Aᵣ(O) × 2 ÷ Mᵣ(SO₂)) × 100% = (16 × 2 ÷ 64) × 100% = 50%
Кроме того, зная химическую формулу, можно определить, имеет ли вещество молекулярное или немолекулярное строение. Таким образом, химическая формула является основным инструментом для изучения состава и свойств химических веществ.
Стр. 41
Примените свои знания
4. Составьте химическую формулу сахарозы, зная, что в состав её молекулы входят 12 атомов углерода, 22 атома водорода и 11 атомов кислорода. Рассчитайте относительную молекулярную массу этого вещества и массовые доли образующих его элементов.
Химическая формула сахарозы – C₁₂H₂₂O₁₁, так как молекула содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Рассчитаем относительную молекулярную массу сахарозы (Mᵣ).
Используем относительные атомные массы элементов:
Aᵣ(C) = 12
Aᵣ(H) = 1
Aᵣ(O) = 16
Теперь вычислим:
Mᵣ(C₁₂H₂₂O₁₁) = (12 × 12) + (22 × 1) + (11 × 16)
= 144 + 22 + 176 = 342
Относительная молекулярная масса сахарозы Mᵣ = 342.
Рассчитаем массовые доли элементов
Формула массовой доли элемента:
w(Э) = (Aᵣ(Э) × n(Э) ÷ Mᵣ(вещества)) × 100%
Массовая доля углерода (C):
w(C) = (12 × 12 ÷ 342) × 100% = (144 ÷ 342) × 100% ≈ 42.1%
Массовая доля водорода (H):
w(H) = (22 × 1 ÷ 342) × 100% = (22 ÷ 342) × 100% ≈ 6.4%
Массовая доля кислорода (O):
w(O) = (11 × 16 ÷ 342) × 100% = (176 ÷ 342) × 100% ≈ 51.5%
Ответ:
Формула сахарозы: C₁₂H₂₂O₁₁
Mᵣ = 342
Массовые доли элементов:
w(C) ≈ 42.1%
w(H) ≈ 6.4%
w(O) ≈ 51.5%
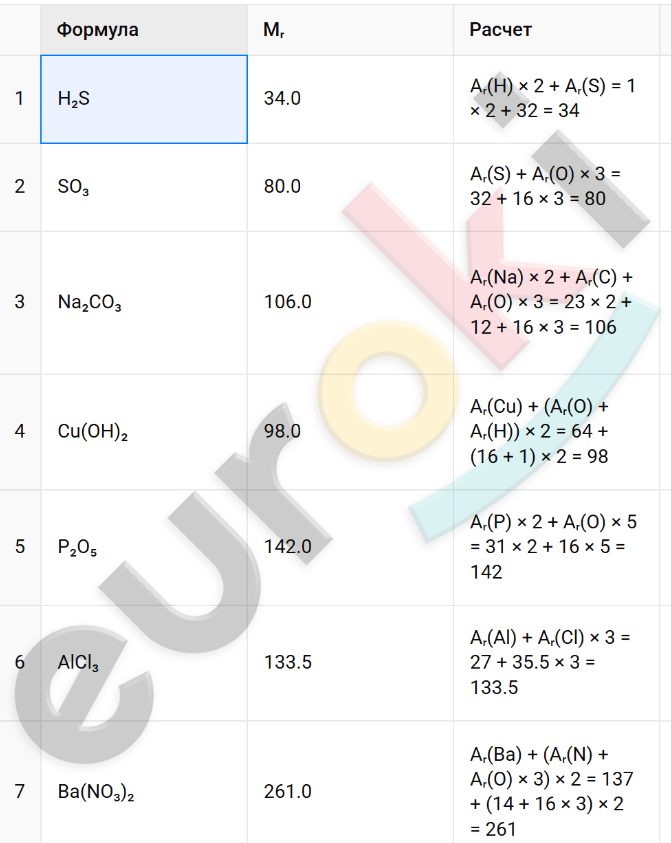
5. Рассчитайте относительные молекулярные массы веществ, формулы которых: H₂S, SO₃, Na₂CO₃, Cu(OH)₂, P₂O₅, AlCl₃, Ba(NO₃)₂.
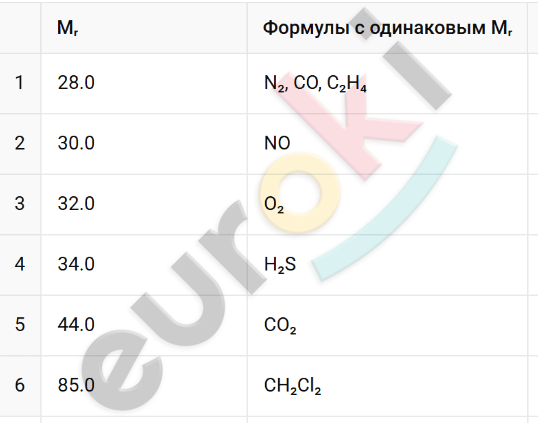
6. Укажите формулы веществ, имеющих одинаковые относительные молекулярные массы: CO₂, N₂, CH₂Cl₂, NO, CO, C₂H₄, H₂S, O₂.
7. Рассчитайте, во сколько раз молекула водорода легче молекулы сернистого газа. Формула водорода — H₂, сернистого газа — SO₂.
Вычисляем относительную молекулярную массу водорода:
Mᵣ(H₂) = 2 × Aᵣ(H) = 2 × 1 = 2
Вычисляем относительную молекулярную массу сернистого газа:
Mᵣ(SO₂) = Aᵣ(S) + 2 × Aᵣ(O) = 32 + 2 × 16 = 64
Определяем, во сколько раз молекула водорода легче молекулы сернистого газа:
64 ÷ 2 = 32
Ответ:
Молекула водорода легче молекулы сернистого газа в 32 раза.
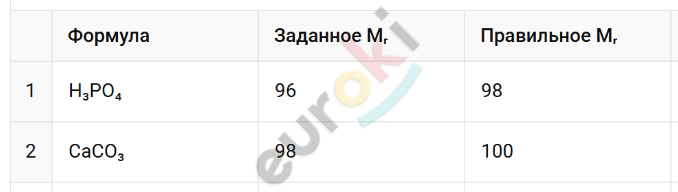
8. Найдите ошибки, допущенные в вычислениях относительных масс веществ.
9. Рассчитайте массовые доли элементов в карбонате кальция, формула которого CaCO₃.
Вычисляем относительную молекулярную массу CaCO₃:
Mᵣ(CaCO₃) = Aᵣ(Ca) + Aᵣ(C) + 3 × Aᵣ(O) = 40 + 12 + 3 × 16 = 100
Вычисляем массовые доли элементов по формуле:
w(Э) = (Aᵣ(Э) ÷ Mᵣ(вещества)) × 100%
Массовая доля кальция:
w(Ca) = (40 ÷ 100) × 100% = 40.0%
Массовая доля углерода:
w(C) = (12 ÷ 100) × 100% = 12.0%
Массовая доля кислорода:
w(O) = (48 ÷ 100) × 100% = 48.0%
Ответ:
Массовые доли элементов в CaCO₃:
Кальций (Ca) ≈ 40.0%
Углерод (C) ≈ 12.0%
Кислород (O) ≈ 48.0%
10. Расположите названия азотных удобрений, формулы которых приведены ниже, в порядке возрастания массовой доли азота в них: Натриевая селитра (NaNO₃); Кальциевая селитра (Ca(NO₃)₂); Аммиачная селитра (NH₄NO₃).
Рассчитаем массовые доли азота:
Натриевая селитра (NaNO₃):
Mᵣ(NaNO₃) = 23 + 14 + (16 × 3) = 85
w(N) = (14 ÷ 85) × 100% ≈ 16.5%
Кальциевая селитра (Ca(NO₃)₂):
Mᵣ(Ca(NO₃)₂) = 40 + (2 × 14) + (6 × 16) = 164
w(N) = (2 × 14 ÷ 164) × 100% ≈ 17.1%
Аммиачная селитра (NH₄NO₃):
Mᵣ(NH₄NO₃) = (2 × 14) + (4 × 1) + (3 × 16) = 80
w(N) = (2 × 14 ÷ 80) × 100% ≈ 35.0%
Правильный порядок:
Натриевая селитра (NaNO₃) ≈ 16.5%
Кальциевая селитра (Ca(NO₃)₂) ≈ 17.1%
Аммиачная селитра (NH₄NO₃) ≈ 35.0%







