Решебник по химии 8 класс Габриелян | Страница 159
Страница 159
Проверьте свои знания
1. Что такое электроотрицательность?
Электроотрицательность — это способность атома химического элемента притягивать к себе общие электронные пары в химических связях. Этот параметр показывает, насколько сильно атом удерживает электроны в соединении.
Электроотрицательность зависит от:
-
Положения элемента в Периодической системе:
В периоде слева направо электроотрицательность увеличивается.
В группе сверху вниз электроотрицательность уменьшается.
-
Строения атома:
Чем меньше радиус атома, тем сильнее его ядро притягивает электроны.
Чем больше заряд ядра, тем выше электроотрицательность.
Самый электроотрицательный элемент — фтор (F), затем идут кислород (O), азот (N) и хлор (Cl).
Электроотрицательность влияет на тип химической связи:
Если разница электроотрицательностей мала (например, H₂, O₂) → ковалентная неполярная связь.
Если разница значительная (например, HCl, H₂O) → ковалентная полярная связь.
Если разница очень большая (например, NaCl, KBr) → ионная связь.
2. Какая химическая связь называется ковалентной полярной? Чем она отличается от ковалентной неполярной связи?
Ковалентная полярная связь — это разновидность ковалентной связи, которая образуется между атомами разных элементов с различной электроотрицательностью. При этом общая электронная пара смещена к более электроотрицательному атому, создавая частичные заряды (δ⁺ и δ⁻).
Пример:
В молекуле HCl хлор (Cl) более электроотрицателен, чем водород (H), поэтому электронная плотность смещается к хлору, создавая полюса:
(H⁺δ — Cl⁻δ)
Отличия от ковалентной неполярной связи:
В ковалентной полярной связи электроны смещены к одному из атомов (например, HCl, H₂O).
В ковалентной неполярной связи электроны равномерно распределены между атомами (например, O₂, N₂).
Таким образом, ковалентная полярная связь характеризуется дипольным моментом и способствует образованию водородных связей (как в воде).
3. Как изменяется ковалентный радиус химических элементов в молекулах метана CH₄ и тетрахлорметана CCl₄?
Ковалентный радиус — это половина расстояния между ядрами двух одинаковых атомов, соединённых ковалентной связью.
В молекулах CH₄ и CCl₄ центральный атом углерод (C) имеет одинаковый ковалентный радиус, но радиус атомов-заместителей (H и Cl) различается.
В CH₄ (метане) атомы водорода (H) маленькие, и связи C—H короче.
В CCl₄ (тетрахлорметане) атомы хлора (Cl) больше, чем водород, поэтому связи C—Cl длиннее.
Таким образом, ковалентный радиус центрального атома C не изменяется, но радиус связи (C—H и C—Cl) различается, потому что атомы водорода меньше, чем хлор.
4. Запишите схему образования ковалентной связи в молекуле перекиси водорода H₂O₂.
В молекуле перекиси водорода (H₂O₂) атомы кислорода соединены друг с другом и с атомами водорода ковалентными полярными связями.
Электронная схема:
(H∙ + ∙O∙ + ∙O∙ + ∙H → H—O—O—H)
Структурная формула:
(H—O—O—H)
Каждый атом кислорода имеет две связи:
Одна связь с атомом водорода (H).
Одна связь с другим атомом кислорода (O).
Таким образом, молекула H₂O₂ имеет угловую форму, а между молекулами возможны водородные связи.
Стр. 159
Примените свои знания
5. Расположите в ряд по увеличению полярности ковалентной связи формулы следующих веществ: а) бромоводород; б) фтороводород; в) хлороводород; г) йодоводород. Поясните свой ответ.
Полярность ковалентной связи зависит от разницы электроотрицательностей (ЭО) элементов, образующих связь. Чем больше разница ЭО, тем сильнее смещается электронная плотность, и тем более полярной становится связь.
Электроотрицательности галогенов по шкале Полинга:
Йод (I) — 2.66
Бром (Br) — 2.96
Хлор (Cl) — 3.16
Фтор (F) — 3.98
Электроотрицательность водорода (H) = 2.20.
Теперь рассчитаем разницу электроотрицательностей (ΔЭО) для каждой молекулы:
Йодоводород (HI): 2.66 - 2.20 = 0.46
Бромоводород (HBr): 2.96 - 2.20 = 0.76
Хлороводород (HCl): 3.16 - 2.20 = 0.96
Фтороводород (HF): 3.98 - 2.20 = 1.78
Чем выше ΔЭО, тем более полярна связь.
Располагаем вещества по увеличению полярности связи:
HI < HBr < HCl < HF
Таким образом, йодоводород (HI) имеет наименьшую полярность, а фтороводород (HF) — наибольшую. Это объясняется тем, что фтор — самый электроотрицательный элемент, а йод — наименее электроотрицательный среди галогенов.
6. Запишите структурные формулы и определите знаки частичных зарядов на атомах в молекулах аммиака NH₃ и сернистого газа SO₂.
Структурная формула:
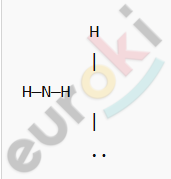
Атом азота (N) имеет пять валентных электронов, три из которых он использует для образования ковалентных полярных связей с атомами водорода (H). Четвёртая электронная пара остаётся неподелённой, что придаёт молекуле пирамидальную форму.
Электроотрицательности:
Азот (N) = 3.04
Водород (H) = 2.20
ΔЭО = 3.04 - 2.20 = 0.84 → Полярная связь
Заряд на атомах:
Азот (N) более электроотрицателен → частичный отрицательный заряд (δ⁻).
Водород (H) менее электроотрицателен → частичный положительный заряд (δ⁺).
Обозначение полярности:
(H⁺δ — N⁻δ — H⁺δ)
Молекула сернистого газа (SO₂)
Структурная формула:
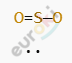
Атом серы (S) соединён с двумя атомами кислорода двойными ковалентными полярными связями. Кислород более электроотрицателен, чем сера, поэтому электронная плотность смещена к кислороду.
Электроотрицательности:
Кислород (O) = 3.44
Сера (S) = 2.58
ΔЭО = 3.44 - 2.58 = 0.86 → Полярная связь
Заряд на атомах:
Кислород (O) более электроотрицателен → частичный отрицательный заряд (δ⁻).
Сера (S) менее электроотрицательна → частичный положительный заряд (δ⁺).
Обозначение полярности:
(O⁻δ = S⁺δ — O⁻δ)
Таким образом, молекулы NH₃ и SO₂ имеют полярные связи, но аммиак обладает пирамидальной структурой, а сернистый газ — угловой формой из-за неподелённых электронных пар.







