Решебник по химии 8 класс Габриелян | Страница 139
Страница 139
Проверьте свои знания
1. Дайте определение электронной оболочки атома и энергетического уровня (электронного слоя).
Электронная оболочка атома – это совокупность всех электронов, которые вращаются вокруг ядра атома, образуя электронное облако. Электронная оболочка состоит из энергетических уровней, или электронных слоёв, на которых электроны распределяются в соответствии с квантовыми законами.
Энергетический уровень (электронный слой) – это область вокруг ядра атома, в которой наиболее вероятно находится определённое число электронов. Число таких уровней у атома определяется его порядковым номером и увеличивается в зависимости от периода, в котором расположен элемент в Периодической системе Менделеева.
2. Каков порядок заполнения электронных слоёв у атомов элементов № 1–20 в таблице Д. И. Менделеева?
Заполнение электронных слоёв у атомов элементов происходит по правилу 2n², где n – номер энергетического уровня. Согласно этому правилу:
Первый уровень (n = 1) может содержать максимум 2 электрона,
Второй уровень (n = 2) – до 8 электронов,
Третий уровень (n = 3) – до 18 электронов, но для элементов до 20-го номера заполняется максимум 8,
Четвёртый уровень (n = 4) – до 32 электронов, но у элементов первой двадцатки в нём пока только 2 электрона.
Пример распределения электронов:
У атома водорода (Z = 1) – 1 электрон (1s¹),
У атома неона (Z = 10) – 2 электрона на первом уровне, 8 на втором (1s² 2s² 2p⁶),
У атома кальция (Z = 20) – 2 электрона на первом, 8 на втором, 8 на третьем и 2 на четвёртом (1s² 2s² 2p⁶ 3s² 3p⁶ 4s²).
3. Какие энергетические уровни атома называют завершёнными? Как рассчитать максимальное число электронов, которые может вместить n-й энергетический уровень?
Завершённые энергетические уровни – это те уровни, которые содержат максимальное возможное число электронов в соответствии с правилом 2n². У элементов главных подгрупп завершёнными уровнями являются те, которые содержат 2 (у гелия), 8 (у неона, аргона) или 18 электронов.
Максимальное число электронов на n-м энергетическом уровне вычисляется по формуле 2n²:
1-й уровень: (2 × 1²) = 2 электрона,
2-й уровень: (2 × 2²) = 8 электронов,
3-й уровень: (2 × 3²) = 18 электронов,
4-й уровень: (2 × 4²) = 32 электрона и так далее.
4. Объясните причину сходства свойств элементов VA-группы. Запишите формулы высших оксидов и летучих водородных соединений элементов этой группы.
Сходство химических свойств элементов VA-группы объясняется одинаковым числом валентных электронов (5) на внешнем энергетическом уровне. Эти элементы (азот, фосфор, мышьяк, сурьма, висмут) могут проявлять степени окисления от -3 до +5, что позволяет им образовывать схожие соединения.
Формулы высших оксидов:
(N₂O₅), (P₂O₅), (As₂O₅), (Sb₂O₅), (Bi₂O₅).
Формулы летучих водородных соединений:
(NH₃), (PH₃), (AsH₃), (SbH₃), (BiH₃).
Эти соединения обладают аналогичными химическими свойствами, но с возрастанием атомного номера элементы становятся менее неметаллическими, а их соединения менее устойчивыми.
Стр. 139
Примените свои знания
5. Укажите общее число электронов и число энергетических уровней в атомах элементов следующих групп:
а) щелочных металлов;
б) щелочноземельных металлов;
в) галогенов;
г) благородных газов.
а) щелочных металлов
Щелочные металлы находятся в первой группе периодической таблицы. У них один валентный электрон и количество уровней равно номеру периода. Например:
Литий (Li) – 3 электрона, 2 уровня
Натрий (Na) – 11 электронов, 3 уровня
Калий (K) – 19 электронов, 4 уровня
б) щелочноземельных металлов
Щелочноземельные металлы относятся ко второй группе периодической системы. У них два валентных электрона, а число уровней соответствует номеру периода. Например:
Бериллий (Be) – 4 электрона, 2 уровня
Магний (Mg) – 12 электронов, 3 уровня
Кальций (Ca) – 20 электронов, 4 уровня
в) галогенов
Галогены принадлежат к 17-й группе (VIIA) и имеют 7 валентных электронов. Их число уровней равно номеру периода. Например:
Фтор (F) – 9 электронов, 2 уровня
Хлор (Cl) – 17 электронов, 3 уровня
Бром (Br) – 35 электронов, 4 уровня
г) благородных газов
Благородные газы находятся в 18-й группе (VIIIA). Их внешний уровень завершён, что делает их химически инертными. Число уровней соответствует номеру периода. Например:
Неон (Ne) – 10 электронов, 2 уровня
Аргон (Ar) – 18 электронов, 3 уровня
Криптон (Kr) – 36 электронов, 4 уровня
6. Запишите распределение электронов по энергетическим уровням в атомах следующих элементов:
а) магний;
б) кальций;
в) алюминий;
г) фосфор;
д) хлор.
а) магния
Атомный номер: 12
Электронная конфигурация: (2e⁻, 8e⁻, 2e⁻)
б) кальция
Атомный номер: 20
Электронная конфигурация: (2e⁻, 8e⁻, 8e⁻, 2e⁻)
в) алюминия
Атомный номер: 13
Электронная конфигурация: (2e⁻, 8e⁻, 3e⁻)
г) фосфора
Атомный номер: 15
Электронная конфигурация: (2e⁻, 8e⁻, 5e⁻)
д) хлора
Атомный номер: 17
Электронная конфигурация: (2e⁻, 8e⁻, 7e⁻)
7. Назовите химические элементы, расположение электронов по энергетическим уровням которых соответствует ряду чисел:
а) 2, 1;
б) 2, 8, 1;
в) 2, 8, 7;
г) 2, 8, 8, 2.
а) 2, 1;
Этот набор электронов соответствует атому лития (Li), так как у лития три электрона: два находятся на первом уровне, один — на втором.
б) 2, 8, 1;
Такое распределение характерно для атома натрия (Na), поскольку у него 11 электронов: два на первом уровне, восемь на втором и один на третьем.
в) 2, 8, 7;
Такой порядок характерен для атома хлора (Cl), так как у него 17 электронов: два на первом уровне, восемь на втором и семь на третьем.
г) 2, 8, 8, 2;
Данное распределение соответствует атому кальция (Ca), так как у него 20 электронов: два на первом уровне, восемь на втором, восемь на третьем и два на четвертом.
8. Какие из наборов чисел и почему не могут соответствовать распределению электронов по энергетическим уровням атома химического элемента:
а) 2, 7, 1;
б) 2, 3;
в) 1, 8, 1;
г) 2, 9;
д) 2, 7;
е) 2, 7,
ж) 2, 8, 8?
а) 2, 7, 1;
Этот набор невозможен, так как на втором уровне не может быть 7 электронов, если на третьем уровне находится 1 электрон. Энергетические уровни заполняются последовательно, и третий уровень заполняется только после второго.
б) 2, 3;
Такое распределение невозможно, так как второй уровень может содержать до 8 электронов, а 3 электрона на втором уровне без завершения первого противоречит правилу заполнения уровней.
в) 1, 8, 1;
Неверный набор, потому что первый энергетический уровень может содержать максимум 2 электрона, а не 1.
г) 2, 9;
Данный вариант невозможен, так как второй энергетический уровень может содержать максимум 8 электронов.
д) 2, 7;
Этот набор возможен, так как он соответствует атому фтора (F), у которого 9 электронов.
е) 2, 7;
Набор 2, 7 возможен, он соответствует атому фтора (F).
ж) 2, 8, 8;
Набор 2, 8, 8 невозможен, так как третий уровень может содержать максимум 8 электронов, но при этом следующий уровень (четвертый) должен быть заполнен, если элемент находится во втором периоде.
9. Замените X соответствующим символом или цифрой:
а) ¹⁰X 2, 8;
б) X P 2, X, 5;
в) ⁴He X;
г) X X, X, 2.
а) ¹⁰X 2, 8;
Элемент с массовым числом 10 и электронным распределением 2, 8 — это неон (Ne).
б) X P 2, X, 5;
Фосфор (P) имеет 15 электронов, его распределение: 2, 8, 5. Следовательно, X = 15.
в) ⁴He X;
Гелий (He) имеет 2 электрона, следовательно, X = 2.
г) X X, X, 2;
Этот элемент должен иметь два электрона на последнем уровне, значит, это элемент 2-й группы (щелочноземельный металл). Например, кальций (Ca) с распределением 2, 8, 8, 2.
10. Атом гелия содержит на внешнем энергетическом уровне два электрона, подобно атомам бериллия и магния. Почему гелий помещён в Периодической системе Д. И. Менделеева в VIIIA-группу, а не в IIA-группу?
Гелий (He) действительно имеет два электрона на внешнем уровне, что могло бы казаться основанием для его включения в IIA-группу, где находятся щелочноземельные металлы (например, бериллий и магний). Однако гелий принципиально отличается от этих элементов по химическим свойствам. Он является инертным газом и химически практически неактивен, в то время как бериллий и магний активно вступают в химические реакции.
Причина такой разницы в том, что у гелия завершённый энергетический уровень (1s²), что делает его стабильным и неспособным к образованию химических соединений при нормальных условиях. Именно эта инертность является ключевым критерием для его размещения в VIIIА-группе (группе благородных газов), а не в группе щелочноземельных металлов, которые легко образуют соединения.
11. Запишите распределение электронов по энергетическим уровням атома железа, зная, что третий энергетический уровень его не завершён, а на внешнем уровне содержится 2 электрона.
Атом железа (Fe) имеет порядковый номер 26, что означает, что у него 26 электронов. Согласно принципу заполнения энергетических уровней, его электронное распределение будет следующим:
(1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s²) или в сокращённом виде:
(2, 8, 14, 2).
Железо относится к переходным металлам, и его третий уровень (3d-подуровень) не является полностью заполненным, что влияет на его химические свойства, включая способность образовывать соединения с разными степенями окисления.
12. Запишите распределение электронов по энергетическим уровням иона, в который превращается атом кислорода, принявший два электрона.
Атом кислорода (O) имеет порядковый номер 8, что означает, что у него 8 электронов. Его нормальное распределение по энергетическим уровням:
(1s² 2s² 2p⁴) → (2, 6).
При присоединении двух электронов кислород превращается в анион (O²⁻). Теперь у него 10 электронов, и распределение становится:
(1s² 2s² 2p⁶) → (2, 8).
Этот завершённый внешний уровень соответствует электронной конфигурации неона (Ne), что делает ион O²⁻ устойчивым.
13. Запишите распределение электронов по энергетическим уровням иона, в который превращается атом кальция, отдавший два электрона.
Атом кальция (Ca) имеет порядковый номер 20, то есть 20 электронов. Его нормальное распределение по энергетическим уровням:
(1s² 2s² 2p⁶ 3s² 3p⁶ 4s²) → (2, 8, 8, 2).
При потере двух электронов (из 4s²) кальций превращается в катион Ca²⁺. Теперь у него 18 электронов, и новое распределение становится:
(1s² 2s² 2p⁶ 3s² 3p⁶) → (2, 8, 8).
Такой ион устойчив, так как его электронная конфигурация совпадает с конфигурацией атома аргона (Ar).
Стр. 139
Используйте дополнительную информацию
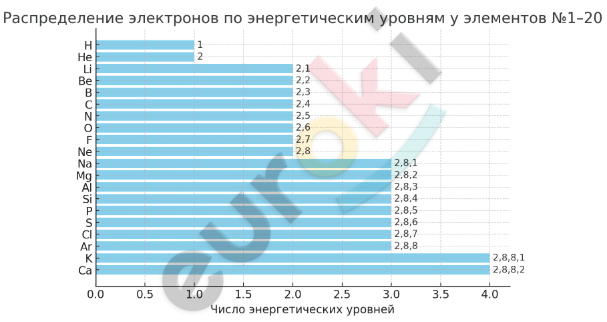
14. Предложите вариант графического отображения памятки о порядке заполнения электронных слоёв у атомов элементов № 1—20 в таблице Д. И. Менделеева.
Вот графическое представление порядка заполнения электронных слоёв у атомов элементов №1–20 в таблице Д. И. Менделеева. Оно показывает количество энергетических уровней и распределение электронов в атомах от водорода до кальция.
Параграф 32. Периодическая система химических элементов Д. И. Менделеева







