Основные оксиды | Конспект
Основные оксиды образованы металлами в степенях окисления +1, +2:
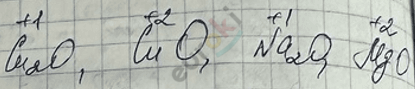
Исключение:
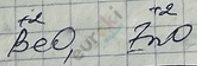 – амфотерные, так как Zn и Be – амфотерные элементы.
– амфотерные, так как Zn и Be – амфотерные элементы.
Химические свойства
1. С водой реагируют только оксиды щелочных (IA) и щёлочноземельных Ме (IIA), кроме Be и Mg.
\(\text{Ca}O\) (негашеная известь) + \(H_{2}O\) = \(\text{Ca}(OH)_{2}\) (гашеная известь)
Реакция гашения извести
\(\text{Mg}O\) + \(H_{2}O \neq\)
2. Основной оксид (щелочного и щёлочноземельного Ме) + кислотный оксид (любой) = соль.

3. Основной оксид + кислота = соль + \(H_{2}O\).
\(\text{Ca}O\) + \(2{H\text{NO}}_{3}\) = \(Ca(NO_{3})_{2}\) + \(H_{2}O\)
4. Кроме оксидов щелочных и щёлочноземельных Ме, а также Mg и Al, все остальные оксиды могут реагировать с:
а) металлами по ряду напряжения по правилу: каждый предыдущий металл вытесняет последующий из состава соли или оксида
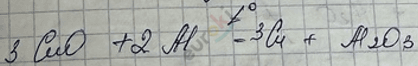
Не надо использовать в этом случае Ме IA и IIA, так как они сами окисляются \(O_{2}\) воздуха.
б) C, Hi, CO с получением Ме
\(3{Fe_{2}O}_{3}\) + \(C\) (недост.) = \(2{Fe_{3}O}_{4}\) + \(CO\)
\({Fe_{2}O}_{3}\) + \(3C\) (изб.) = \(2\text{Fe}\) + \(3\text{CO}\)
\(3{Fe_{2}O}_{3}\) + \(CO\) (недост.) = \(2{Fe_{3}O}_{4}\) + \(CO_{2}\)
\({Fe_{2}O}_{3}\) + \(3CO\) (изб.) = \(2\text{Fe}\) + \(3CO_{2}\)
\({Fe_{2}O}_{3}\) + \(3H_{2}\) (изб.) = \(2\text{Fe}\) + \(3H_{2}O\)


