Химические свойства алканов и способы их получения | Конспект
В промышленных масштабах алканы выделяют из природных источников – природного газа, нефти и попутных нефтяных газов.
В странах, располагающих большими запасами каменного угля, алканы получают газификацией твёрдого топлива.
C + 2H2 → CH4
В лабораториях алканы получают следующими способами:
1. Реакция Вюрца

2. Реакция Дюма

Химические свойства:
Так как алканы являются предельными углеводородами, то для них невозможны реакции присоединения. Для них характерны сложные типы реакции.
I. Реакции замещения протекают по радикальному механизму
1) Галогенирование
а) CH4 + Cl2 → CH3Cl + HCl
б) CH3 – CH2 – CH3 + Br2 → CH3 – CH – CH3 + HBr
2) Нитрование (реакция Коновалова)
CH3 – CH3 + HONO2 → CH3 – CH2 – NO2 + H2O (нитроэтан)
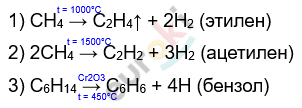
II. Реакция крекинга и ароматизации
III. Реакция горения и каталитического окисления
Все алканы сгорают до углекислого газа и воды.
CH4 + 2O2 → CO2 + 2H2O
При каталитическом окислении алканов образуются кислородсодержащие органические вещества.
Эти реакции лежат в основе производства многих важнейших соединений. Например: при каталитическом окислении бутана в промышленным масштабах получают уксусную кислоту.

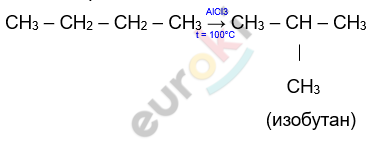
IV. Изомеризация