Основы термодинамики | Конспект
МКТ в теоретической физике называется статистической механикой, так как рассматривается движение молекул.
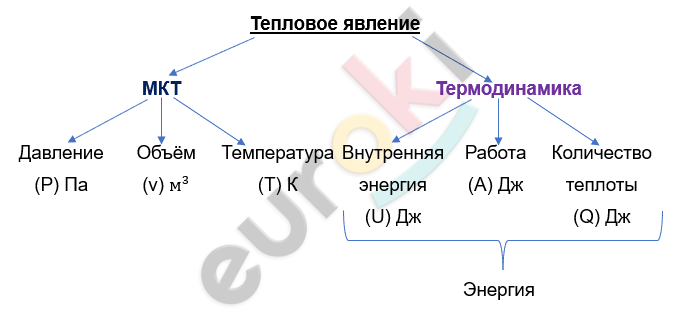
Также к разделу изучения тепловых явлений относится термодинамика.
Термодинамика и статистическая механика дополняют друг друга и изучают разными методами одни и те же процессы.
В термодинамике есть понятие термодинамической системы – это совокупность взаимодействующих тел, которые обмениваются друг с другом энергией и веществом.
U – внутренняя энергия (Дж)
U \(\sim\) T
U = \(\frac{3}{2}\) vRT
v = \(\frac{m}{M}\) = \(\frac{N}{N_{a}}\)
\(\mathrm{\Delta}\)U – всегда связана с изменением температуры, следовательно, в изотермическом процессе:
\(\mathrm{\Delta}\)U = 0
\(\mathrm{\Delta}\)U = \(\frac{3}{2}\) vR\(\mathrm{\Delta}\)T
\(\mathrm{\Delta}\)Т = 0
\(\mathrm{\Delta}\)U = 0
А – работа (Дж)
Если газ сам совершает работу, то объём при этом увеличивается, то есть газ расширяется.
\(А^{'}\) = p\(\mathrm{\Delta}\)V – работа газа
Если над газом совершают работу, то объём газа уменьшается, то есть газ сжимается.
А = –\(А^{'}\) – работа внешних сил
Если \(\mathrm{\Delta}\)V = 0, то \(А^{'}\) = 0 (изохорный)

Q – количество теплоты (Дж)
Q = cm\(\mathrm{\Delta}\)T – нагревание (энергия потребляется) / охлаждение (энергия выделяется)
Q = λm – плавление (энергия потребляется) / кристаллизация (энергия выделяется)
Q = Lm – парообразование (энергия потребляется) / конденсация (энергия выделяется)
Q = gm – сгорание (выделяется)
Потребление энергии => Q > 0
Энергия выделяется => Q < 0
Передача тепла всегда происходит от более горячего тела к более холодному.
Уравнение теплового баланса: \(Q_{1}\) + \(Q_{2}\) + \(Q_{3}\) + ... = 0
Первый закон термодинамики – это частный случай закона сохранения энергии (энергия в природе не возникает из ничего и не исчезает), она только переходит из одной формы в другую.


