Решебник по химии 8 класс Габриелян §9
§9
Химические реакции
Стр. 46
Вопрос
Какие признаки указывают на протекание химической реакции?
Химическая реакция – это процесс, при котором одни вещества превращаются в другие с изменением их состава и свойств. Существует несколько основных признаков, по которым можно определить, что химическая реакция действительно произошла.
Выделение газа – если в ходе реакции образуются пузырьки газа, это свидетельствует о химическом превращении. Например, при взаимодействии мрамора (CaCO₃) с кислотами выделяется углекислый газ (CO₂).
Выпадение осадка – образование нерастворимого вещества в растворе указывает на протекание реакции. Например, при смешивании нитрата серебра (AgNO₃) с хлоридом натрия (NaCl) выпадает белый осадок хлорида серебра (AgCl).
Изменение цвета – появление нового цвета в растворе или веществе является признаком химической реакции. Например, при реакции сульфата меди (CuSO₄) с аммиаком раствор окрашивается в ярко-синий цвет.
Выделение или поглощение тепла – при экзотермических реакциях выделяется тепло (горение, разложение дихромата аммония), а при эндотермических реакциях, наоборот, тепло поглощается (разложение карбонатов при нагревании).
Излучение света – некоторые реакции сопровождаются свечением. Например, горение магния сопровождается ярким белым светом.
Появление запаха – в ряде реакций выделяются летучие вещества с характерным запахом, например, при разложении белка или горении органических веществ.
Вывод:
Признаки химической реакции позволяют определить, что произошли химические изменения. Однако в ряде случаев требуется дополнительный анализ, например, осаждение или нагревание, чтобы убедиться в том, что изменение действительно связано с химическим процессом.
Стр. 46
Лабораторный опыт 5
В одну пробирку налейте 1 мл раствора хлорида натрия, в другую — 1 мл раствора иодида калия. С помощью пипетки в каждую пробирку добавьте 4–5 капель раствора нитрата серебра. Что наблюдаете?
При добавлении нитрата серебра (AgNO₃) в раствор хлорида натрия (NaCl) происходит химическая реакция обмена:
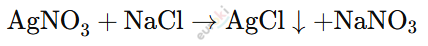
Наблюдение: В пробирке образуется белый осадок хлорида серебра (AgCl), который не растворяется в воде.
При добавлении нитрата серебра (AgNO₃) в раствор иодида калия (KI) также происходит реакция обмена:
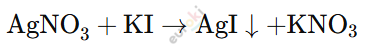
Наблюдение: В этой пробирке образуется жёлтый осадок иодида серебра (AgI).
Вывод:
В ходе реакции в обеих пробирках выпадают осадки, что является признаком химической реакции.
Осадок AgCl (хлорид серебра) – белый, а AgI (иодид серебра) – жёлтый.
Реакция подтверждает разную растворимость галогенидов серебра: хлорид серебра более растворим, чем иодид серебра.
Этот опыт иллюстрирует признак химической реакции – образование осадка.
Стр. 47
Лабораторный опыт 6
Получение гидроксида меди(II).
Комментарий к проведению опыта:
При добавлении NaOH в раствор CuSO₄ действительно наблюдается образование голубого осадка Cu(OH)₂, что подтверждает протекание химической реакции.
При добавлении H₂SO₄ осадок растворяется, и раствор приобретает синий цвет, что указывает на обратное превращение в CuSO₄.
Данный опыт демонстрирует признак химической реакции — выпадение осадка и его растворение как подтверждение обратимости реакции.
Вывод:
В ходе опыта был получен нерастворимый гидроксид меди(II), который при взаимодействии с кислотой снова превратился в раствор сульфата меди(II). Это показывает взаимосвязь между реакциями осаждения и растворения, что важно для понимания химического равновесия.
Стр. 47
Лабораторный опыт 7
Поместите в пробирку немного (на кончике шпателя) питьевой соды. Добавьте к ней 1–2 мл раствора уксусной или другой кислоты. Что наблюдаете?
При добавлении уксусной кислоты (CH₃COOH) к питьевой соде (NaHCO₃) начинается химическая реакция, сопровождающаяся бурным выделением газа – углекислого газа (CO₂). Это один из признаков химической реакции – образование газа.
Химическое уравнение реакции:
(NaHCO₃)+(CH₃COOH)→(CH₃COONa)+(H₂O)+(CO₂)↑
Наблюдения:
В пробирке появляются пузырьки углекислого газа (CO₂).
Возможно лёгкое вспенивание раствора.
Раствор становится менее прозрачным из-за выделяющихся газовых пузырьков.
Вывод:
Опыт показывает химическое взаимодействие карбоната (гидрокарбоната) с кислотой, что приводит к выделению углекислого газа (CO₂). Этот принцип широко используется:
В кулинарии – при разрыхлении теста (реакция соды с кислотой).
В медицине – в шипучих таблетках.
В школьных экспериментах, таких как «вулкан» с содой и уксусом.
Стр. 47
Вопрос
Какие условия необходимы, чтобы химические вещества вступили в реакцию?
Чтобы химические вещества вступили в реакцию, необходимо соблюдение определённых условий, которые обеспечивают возможность столкновения частиц и протекание химических превращений. Основные условия включают:
Соприкосновение реагентов – вещества должны физически встретиться, чтобы между их частицами могли возникнуть химические взаимодействия. Например, при помещении цинка (Zn) в раствор соляной кислоты (HCl) начинается выделение водорода (H₂).
Наличие энергии активации – для большинства реакций требуется затрата энергии, чтобы разорвать исходные связи и образовать новые. Эту энергию можно получить за счёт нагревания или светового облучения. Например, разложение пероксида водорода (H₂O₂) ускоряется при нагревании или добавлении катализатора.
Изменение давления (для газов) – если реакция происходит между газами, то увеличение давления приводит к сближению молекул, что повышает вероятность их столкновения. Например, при повышенном давлении азот (N₂) и водород (H₂) более активно вступают в реакцию с образованием аммиака (NH₃).
Концентрация реагентов – чем выше концентрация веществ, тем больше вероятность их столкновения и тем быстрее идёт реакция. Это объясняет, почему кислота высокой концентрации реагирует быстрее, чем её разбавленный раствор.
Катализаторы – ускоряют реакцию, уменьшая энергию активации, но сами при этом не расходуются. Например, в разложении пероксида водорода (H₂O₂) катализатором служит оксид марганца (MnO₂).
Свет (фотохимические реакции) – некоторые реакции требуют воздействия света. Например, фотосинтез в растениях возможен только при наличии солнечного света.
Электрический ток (электролиз) – в некоторых реакциях (например, разложении воды на водород и кислород) необходимо прохождение электрического тока через раствор или расплав.
Вывод:
Химическая реакция происходит только при наличии благоприятных условий: соприкосновения реагентов, достаточной энергии, подходящего давления, концентрации, катализаторов или дополнительных внешних воздействий (тепло, свет, электричество). Если этих условий нет, вещества могут находиться вместе, но реакция не произойдёт.
Стр. 49
Проверьте свои знания
1. Чем отличаются химические явления от физических? Приведите примеры.
Химические явления (реакции) — это процессы, в результате которых образуются новые вещества с другими свойствами. Физические явления, напротив, не приводят к образованию новых веществ, а изменяют только их состояние или форму. Например, растворение соли в воде — это физическое явление, потому что вещество остаётся тем же, но изменяет свою форму. Горение бумаги — химическое явление, так как образуются новые вещества: углекислый газ и зола. Еще один пример химического явления — ржавление железа, при котором железо вступает в реакцию с кислородом и влагой, образуя оксиды железа. Лёд, тающий при нагревании, — это физическое явление, потому что состав воды остаётся неизменным. Также к физическим явлениям можно отнести испарение спирта, так как вещество просто переходит в газообразное состояние.
2. Среди приведённых явлений укажите физические и химические: а) образование ржавчины на гвозде; б) растворение сахара в воде; в) вспенивание виноградного сока в шампанском; г) реакция соды с уксусом; д) испарение воды.
Химические явления:
а) образование ржавчины на гвозде – происходит химическая реакция окисления железа с кислородом и влагой, в результате которой образуется оксид железа (ржавчина).
г) реакция соды с уксусом – это химическое явление, так как при взаимодействии бикарбоната натрия (соды) с уксусной кислотой образуется углекислый газ, вода и ацетат натрия.
Физические явления:
б) растворение сахара в воде – сахар не изменяет свой химический состав, а только распределяется в воде.
в) вспенивание виноградного сока в шампанском – это физическое явление, так как углекислый газ просто выделяется из раствора, не изменяя химический состав напитка.
д) испарение воды – вода переходит в газообразное состояние, но остаётся тем же веществом.
3. Опишите принцип действия аппарата Киппа. Какие реагенты используются в нём?
Аппарат Киппа предназначен для получения газов в лабораторных условиях. Он состоит из трёх резервуаров, соединённых так, чтобы жидкий реагент мог контактировать с твёрдым веществом и выделять газ. Чаще всего в нём используют соляную кислоту и цинк для получения водорода. Когда кусковой цинк вступает в реакцию с кислотой, выделяется водород, который можно собирать в пробирку. Если кран закрыт, давление газа увеличивается, жидкость перестаёт поступать, и реакция прекращается. Как только кран открывают, водород выходит наружу, давление снижается, и реакция возобновляется. Таким образом, аппарат Киппа позволяет получать газ в нужный момент без лишних потерь.
4. Какие продукты образуются при разложении дихромата аммония? К какому типу по тепловому эффекту он относится? Какие признаки химической реакции вы наблюдали при этом?
При разложении дихромата аммония (NH₄)₂Cr₂O₇ образуются оксид хрома(III) (Cr₂O₃), азот (N₂) и водяной пар (H₂O). Эта реакция относится к экзотермическим, так как сопровождается выделением большого количества тепла и света. Это проявляется в виде яркого горения с выбросом раскалённых частиц, напоминающих извержение вулкана. Основные признаки химической реакции в данном случае: изменение цвета (образование зелёного оксида хрома), выделение газа (азота и водяного пара) и интенсивное свечение (тепловой эффект). Данная реакция является примером разложения сложного вещества на более простые компоненты, сопровождающегося эффектным визуальным эффектом.
Стр. 49
Примените свои знания
5. Назовите условия протекания химических реакций. Каким образом эти условия используют при разжигании костров и тушении пожаров? Назовите средства тушения пожара, которые есть в кабинете химии.
Химическая реакция возможна только при соблюдении следующих условий:
Соприкосновение реагентов – вещества должны физически контактировать.
Наличие энергии активации – часто требуется нагревание, электричество или свет.
Оптимальная концентрация веществ – чем выше концентрация, тем быстрее идёт реакция.
Давление (для газов) – увеличение давления ускоряет реакции.
Катализаторы – ускоряют реакцию, но не расходуются в процессе.
При разжигании костра используются:
Поджиг (источник высокой температуры – спичка, зажигалка).
Доступ кислорода (обеспечивает горение, костёр раздувают).
Горючие вещества (дрова, бумага).
При тушении пожара условия реакции устраняются:
Ограничение кислорода (покрытие огня песком, накрытие плотной тканью).
Снижение температуры (использование воды или пены).
Применение огнетушителей (содержат углекислый газ (CO₂), порошки или пену).
Средства тушения пожара в кабинете химии:
Песок.
Огнетушители (порошковые или углекислотные).
Асбестовое полотно (для тушения небольших возгораний).
6. Назовите исходные вещества и продукты реакции процесса фотосинтеза. Какое значение имеет этот процесс для существования жизни на Земле?
Фотосинтез – это процесс, при котором растения, используя солнечный свет, превращают углекислый газ (CO₂) и воду (H₂O) в органические вещества и кислород (O₂).
Уравнение фотосинтеза:
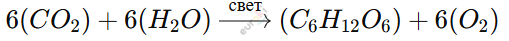
(Образуется глюкоза (C₆H₁₂O₆) и выделяется кислород.)
Значение фотосинтеза:
Обеспечивает кислород – необходим для дыхания живых организмов.
Создаёт органические вещества – растения накапливают энергию, создавая основу пищевой цепи.
Поглощает углекислый газ (CO₂) – регулирует состав атмосферы, предотвращает перегрев Земли.
Образует биомассу – растения служат пищей и сырьём для производства (древесина, бумага, лекарства).
Без фотосинтеза на Земле не существовала бы жизнь в её современном виде, так как не было бы кислорода и органических веществ для питания живых существ.
7. Приведите примеры реакций горения, которые применяют в технике и в быту. Как используют выделяющуюся теплоту?
Горение – это реакция с выделением тепла и света, при которой вещество соединяется с кислородом (O₂).
Примеры реакций горения в быту:
Горение природного газа (CH₄) в газовых плитах:
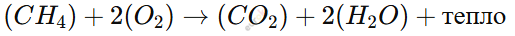 (Используется для приготовления пищи.)
(Используется для приготовления пищи.)
Сжигание бензина (C₈H₁₈) в двигателе автомобиля:
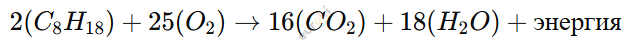 (Обеспечивает движение автомобилей.)
(Обеспечивает движение автомобилей.)
Горение угля (C) в отопительных системах:
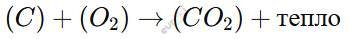
(Используется в котельных для отопления зданий.)
Применение выделяющегося тепла:
Отопление домов (газовые и твердотопливные котлы).
Производство электроэнергии (ТЭС работают на угле, нефти, газе).
Двигатели внутреннего сгорания (автомобили, самолёты).
Промышленные процессы (металлургия, выплавка стекла).
Горение – один из важнейших процессов в технике и быту, позволяющий эффективно использовать энергию химических веществ.
Стр. 49
Используйте дополнительную информацию
8. Подготовьте сообщение о профилактике и тушении лесных пожаров.
Сообщение
Профилактика и тушение лесных пожаров
Лесные пожары – это серьезная экологическая проблема, которая приводит к гибели растений и животных, разрушению экосистем, загрязнению воздуха и значительным экономическим потерям. Чтобы снизить риск возгораний и эффективно бороться с ними, необходимо проводить профилактические мероприятия и знать методы тушения пожаров.
Профилактика лесных пожаров
Основной задачей профилактики является предотвращение возгораний. Для этого следует соблюдать следующие меры:
Контроль за огнем в лесу – нельзя разводить костры в запрещенных местах, оставлять тлеющие угли или бросать непотушенные спички и окурки.
Запрет на сжигание сухой травы и мусора – неконтролируемое горение может быстро распространиться на лесные массивы.
Создание противопожарных разрывов – лесные хозяйства регулярно расчищают территории, создавая полосы, свободные от растительности, чтобы остановить распространение огня.
Использование искрогасителей – на транспортных средствах, работающих вблизи лесов (тракторы, поезда, лесозаготовительная техника), устанавливаются специальные устройства для предотвращения выброса искр.
Патрулирование лесных зон – в пожароопасный сезон усиливается контроль лесов, особенно в местах отдыха людей.
Пропаганда и разъяснительная работа – важно обучать население правилам пожарной безопасности, особенно в летний период.
Тушение лесных пожаров
Если пожар уже начался, его необходимо оперативно ликвидировать, используя разные методы тушения:
Ручное тушение – применяется на ранних стадиях, включает засыпку очага землёй, заливание водой, сбивание огня ветками или лопатами.
Опашка территории – создаётся минерализованная полоса, препятствующая распространению пламени.
Применение специальных химических составов – используют огнетушащие вещества, замедляющие горение.
Авиационное тушение – с самолётов и вертолётов сбрасывают воду или специальные составы на крупные очаги возгорания.
Создание встречного пала – контролируемое сжигание леса перед фронтом пожара, чтобы огонь не мог распространяться дальше.
Вывод
Предотвращение лесных пожаров – это ответственность каждого человека. Соблюдение правил пожарной безопасности, осторожное обращение с огнём и своевременное обнаружение очагов возгорания помогут сохранить природу и предотвратить катастрофические последствия пожаров.
9. Подготовьте сообщение и презентацию о роли огня в истории человечества.
Сообщение
Роль огня в истории человечества
Огонь сыграл важнейшую роль в развитии человеческой цивилизации. Его приручение стало одним из ключевых этапов эволюции, позволив человеку не только выжить в суровых условиях, но и значительно улучшить качество жизни. Огонь дал тепло, защиту от хищников, возможность приготовления пищи и обработки различных материалов, что повлияло на развитие общества и культуры.
Использование огня началось ещё в первобытные времена. Первобытные люди могли наблюдать его во время лесных пожаров или извержений вулканов, но приручить и использовать его научились далеко не сразу. Одним из важнейших открытий стало умение добывать огонь самостоятельно – с помощью трения, высекания искр из камней или использования солнечного света. Это дало возможность не зависеть от природных катастроф, а поддерживать огонь постоянно, что обеспечивало безопасность и удобство в быту.
Приготовление пищи стало одним из важнейших достижений, связанных с огнём. Термическая обработка сделала пищу более питательной и безопасной, так как уничтожала вредные бактерии и паразитов. Это улучшило здоровье людей и способствовало развитию человеческого организма. Благодаря огню пища стала легче перевариваемой, что, возможно, повлияло на развитие мозга, так как организму потребовалось меньше энергии на пищеварение.
Огонь также сыграл огромную роль в ремёслах и технологиях. С его помощью древние люди научились обжигать глину, создавая прочную керамическую посуду и строительные материалы. Позже огонь использовали для обработки металлов, что привело к возникновению бронзового, а затем железного века. Металлургия стала ключевой отраслью, способствовавшей созданию более эффективных инструментов, оружия и машин, что дало огромный толчок развитию цивилизации.
В религии и культуре огонь всегда занимал особое место. Он символизировал свет, тепло, очищение и энергию жизни. Многие древние народы поклонялись огню как божественному явлению, считая его даром богов. В разных культурах существовали ритуалы, связанные с зажиганием священного огня, который использовался в обрядах, праздниках и погребальных церемониях.
С развитием науки и промышленности огонь стал незаменимым источником энергии. Открытие парового двигателя, основанного на сжигании топлива, положило начало индустриальной революции. Впоследствии огонь использовали в двигателях внутреннего сгорания, электростанциях, металлургии, химической промышленности. Без него невозможно представить современные технологии, транспорт и энергетику.
Несмотря на его пользу, огонь всегда представлял опасность. Лесные пожары, пожары в домах и на производствах уничтожали целые поселения, уносили жизни людей и животных. Поэтому человечество постоянно искало способы контроля и борьбы с огнём. Современные противопожарные системы, средства тушения и правила безопасности помогают минимизировать риски и предотвращать катастрофы.
Таким образом, огонь – это одна из величайших сил природы, которая изменила ход истории. Он дал человечеству возможность развиваться, совершенствовать технологии, строить цивилизации и осваивать новые горизонты. Сегодня, несмотря на развитие альтернативных источников энергии, огонь остаётся важнейшим фактором прогресса, обеспечивая тепло, свет, движение и производство во многих сферах жизни.







