Решебник по химии 8 класс Габриелян §7
§7
Химические формулы
Стр. 39
Вопрос
Если в «химической письменности» роль букв играют символы химических элементов, что представляют собой «химические слова»?
В «химической письменности» символы химических элементов выполняют функцию букв, а химические слова можно сравнить с химическими формулами. Каждая химическая формула представляет собой определённое соединение, состоящее из химических элементов, так же как слово в языке состоит из букв. Например, формула H₂O – это «слово», обозначающее воду, а CO₂ – углекислый газ. Таким образом, химические формулы можно воспринимать как «слова» химического языка, которые обозначают вещества. Эти «слова» передают важную информацию о составе и строении соединений. Более сложные химические соединения можно сравнить с длинными словами, состоящими из нескольких элементов, например C₆H₁₂O₆ (глюкоза). Поэтому химические слова – это химические формулы веществ, в которых символы элементов объединяются, формируя новое значение.
Стр. 40
Вопрос
Что такое относительная молекулярная масса вещества и массовая доля химического элемента в составе сложного вещества?
Относительная молекулярная масса вещества – это сумма относительных атомных масс всех элементов, входящих в его состав, с учетом их количества в молекуле. Она обозначается Mᵣ и рассчитывается путем сложения значений Aᵣ (относительных атомных масс) элементов, умноженных на соответствующие индексы. Например, для сернистого газа SO₂ она вычисляется так:
Mᵣ(SO₂) = Aᵣ(S) + 2 × Aᵣ(O) = 32 + 2 × 16 = 64
Массовая доля химического элемента в составе сложного вещества показывает, какая часть массы соединения приходится на данный элемент. Она обозначается w(Э) и рассчитывается по формуле:
w(Э) = (Aᵣ(Э) × n(Э)) ÷ Mᵣ(вещества) × 100%
Где Aᵣ(Э) – относительная атомная масса элемента, n(Э) – число его атомов в молекуле вещества, Mᵣ(вещества) – относительная молекулярная масса соединения. Например, массовая доля серы в SO₂:
w(S) = (32 ÷ 64) × 100% = 50%
Таким образом, относительная молекулярная масса показывает, насколько молекула тяжелее 1/12 массы атома углерода, а массовая доля элемента определяет, сколько процентов от общей массы вещества приходится на данный элемент.
Стр. 41
Проверьте свои знания
1. Что представляет собой химическая формула? Чем различаются индексы и коэффициенты?
Химическая формула – это обозначение состава вещества с помощью символов химических элементов и индексов. Она показывает, какие элементы входят в состав вещества и в каких количественных соотношениях. В химической формуле используются индексы – маленькие цифры, записанные справа внизу от символа элемента. Индексы указывают число атомов данного элемента в молекуле или формульной единице вещества. Например, в формуле воды H₂O индекс 2 означает, что в молекуле содержится два атома водорода. Коэффициенты, в отличие от индексов, ставятся перед формулой вещества и показывают число молекул. Например, запись 5CO₂ означает пять молекул углекислого газа. Таким образом, индексы указывают число атомов в одной молекуле, а коэффициенты – число молекул в уравнениях реакций.
2. Что называют относительной атомной массой и относительной молекулярной массой?
Относительная атомная масса – это величина, показывающая, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода-12. Она обозначается Aᵣ и не имеет единиц измерения, так как является относительной величиной. Например, для кислорода Aᵣ(O) = 16, а для углерода Aᵣ(C) = 12.
Относительная молекулярная масса – это сумма относительных атомных масс всех атомов, входящих в состав молекулы вещества. Она обозначается Mᵣ и рассчитывается путем сложения Aᵣ элементов с учетом их индексов. Например, для углекислого газа:
Mᵣ(CO₂) = Aᵣ(C) + 2 × Aᵣ(O) = 12 + 2 × 16 = 44
Эта величина важна для расчета масс веществ в химических реакциях и определения массовых долей элементов в сложных соединениях.
3. Какую информацию несёт химическая формула?
Химическая формула несёт несколько важных видов информации о веществе. Во-первых, она указывает, из каких элементов состоит данное вещество, то есть определяет его качественный состав. Во-вторых, химическая формула показывает количественное соотношение атомов в молекуле или формульной единице, то есть сколько атомов каждого элемента содержится в соединении. Например, формула серной кислоты H₂SO₄ говорит о том, что в её составе два атома водорода, один атом серы и четыре атома кислорода.
В-третьих, химическая формула помогает вычислять относительную молекулярную массу соединения, а также массовые доли элементов в составе вещества. Например, для сернистого газа:
Mᵣ(SO₂) = Aᵣ(S) + 2 × Aᵣ(O) = 32 + 2 × 16 = 64
Далее можно рассчитать массовые доли элементов:
w(S) = (Aᵣ(S) ÷ Mᵣ(SO₂)) × 100% = (32 ÷ 64) × 100% = 50%
w(O) = (Aᵣ(O) × 2 ÷ Mᵣ(SO₂)) × 100% = (16 × 2 ÷ 64) × 100% = 50%
Кроме того, зная химическую формулу, можно определить, имеет ли вещество молекулярное или немолекулярное строение. Таким образом, химическая формула является основным инструментом для изучения состава и свойств химических веществ.
Стр. 41
Примените свои знания
4. Составьте химическую формулу сахарозы, зная, что в состав её молекулы входят 12 атомов углерода, 22 атома водорода и 11 атомов кислорода. Рассчитайте относительную молекулярную массу этого вещества и массовые доли образующих его элементов.
Химическая формула сахарозы – C₁₂H₂₂O₁₁, так как молекула содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Рассчитаем относительную молекулярную массу сахарозы (Mᵣ).
Используем относительные атомные массы элементов:
Aᵣ(C) = 12
Aᵣ(H) = 1
Aᵣ(O) = 16
Теперь вычислим:
Mᵣ(C₁₂H₂₂O₁₁) = (12 × 12) + (22 × 1) + (11 × 16)
= 144 + 22 + 176 = 342
Относительная молекулярная масса сахарозы Mᵣ = 342.
Рассчитаем массовые доли элементов
Формула массовой доли элемента:
w(Э) = (Aᵣ(Э) × n(Э) ÷ Mᵣ(вещества)) × 100%
Массовая доля углерода (C):
w(C) = (12 × 12 ÷ 342) × 100% = (144 ÷ 342) × 100% ≈ 42.1%
Массовая доля водорода (H):
w(H) = (22 × 1 ÷ 342) × 100% = (22 ÷ 342) × 100% ≈ 6.4%
Массовая доля кислорода (O):
w(O) = (11 × 16 ÷ 342) × 100% = (176 ÷ 342) × 100% ≈ 51.5%
Ответ:
Формула сахарозы: C₁₂H₂₂O₁₁
Mᵣ = 342
Массовые доли элементов:
w(C) ≈ 42.1%
w(H) ≈ 6.4%
w(O) ≈ 51.5%
5. Рассчитайте относительные молекулярные массы веществ, формулы которых: H₂S, SO₃, Na₂CO₃, Cu(OH)₂, P₂O₅, AlCl₃, Ba(NO₃)₂.
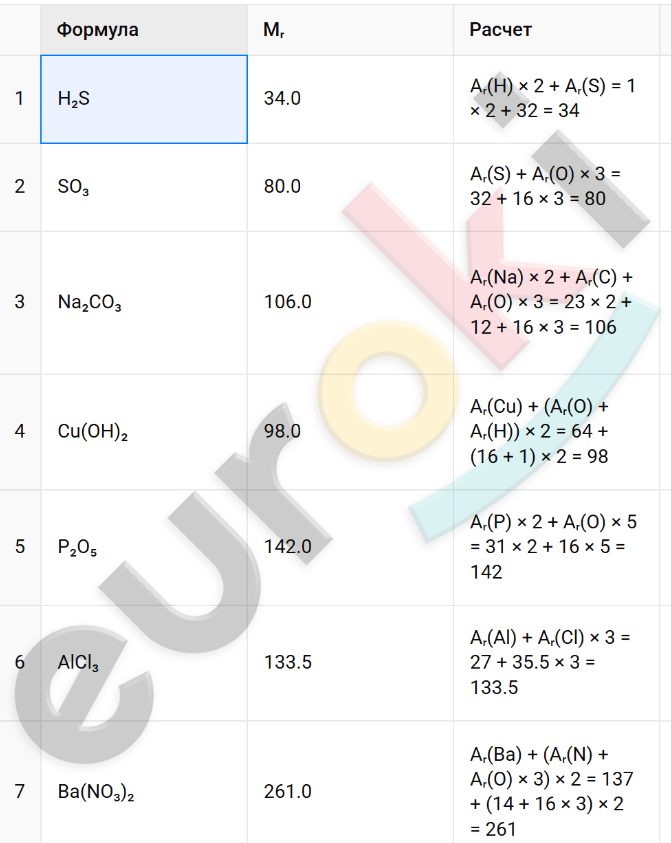
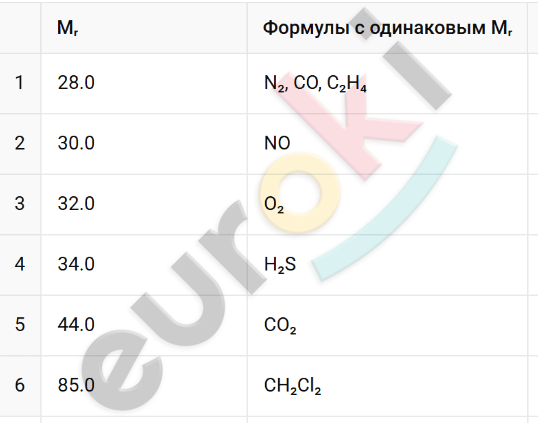
6. Укажите формулы веществ, имеющих одинаковые относительные молекулярные массы: CO₂, N₂, CH₂Cl₂, NO, CO, C₂H₄, H₂S, O₂.
7. Рассчитайте, во сколько раз молекула водорода легче молекулы сернистого газа. Формула водорода — H₂, сернистого газа — SO₂.
Вычисляем относительную молекулярную массу водорода:
Mᵣ(H₂) = 2 × Aᵣ(H) = 2 × 1 = 2
Вычисляем относительную молекулярную массу сернистого газа:
Mᵣ(SO₂) = Aᵣ(S) + 2 × Aᵣ(O) = 32 + 2 × 16 = 64
Определяем, во сколько раз молекула водорода легче молекулы сернистого газа:
64 ÷ 2 = 32
Ответ:
Молекула водорода легче молекулы сернистого газа в 32 раза.
8. Найдите ошибки, допущенные в вычислениях относительных масс веществ.
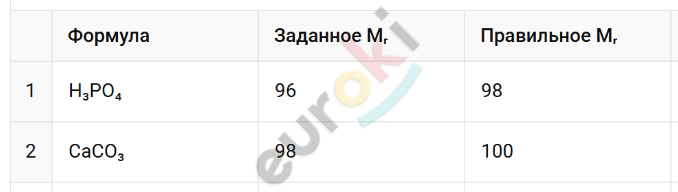
9. Рассчитайте массовые доли элементов в карбонате кальция, формула которого CaCO₃.
Вычисляем относительную молекулярную массу CaCO₃:
Mᵣ(CaCO₃) = Aᵣ(Ca) + Aᵣ(C) + 3 × Aᵣ(O) = 40 + 12 + 3 × 16 = 100
Вычисляем массовые доли элементов по формуле:
w(Э) = (Aᵣ(Э) ÷ Mᵣ(вещества)) × 100%
Массовая доля кальция:
w(Ca) = (40 ÷ 100) × 100% = 40.0%
Массовая доля углерода:
w(C) = (12 ÷ 100) × 100% = 12.0%
Массовая доля кислорода:
w(O) = (48 ÷ 100) × 100% = 48.0%
Ответ:
Массовые доли элементов в CaCO₃:
Кальций (Ca) ≈ 40.0%
Углерод (C) ≈ 12.0%
Кислород (O) ≈ 48.0%
10. Расположите названия азотных удобрений, формулы которых приведены ниже, в порядке возрастания массовой доли азота в них: Натриевая селитра (NaNO₃); Кальциевая селитра (Ca(NO₃)₂); Аммиачная селитра (NH₄NO₃).
Рассчитаем массовые доли азота:
Натриевая селитра (NaNO₃):
Mᵣ(NaNO₃) = 23 + 14 + (16 × 3) = 85
w(N) = (14 ÷ 85) × 100% ≈ 16.5%
Кальциевая селитра (Ca(NO₃)₂):
Mᵣ(Ca(NO₃)₂) = 40 + (2 × 14) + (6 × 16) = 164
w(N) = (2 × 14 ÷ 164) × 100% ≈ 17.1%
Аммиачная селитра (NH₄NO₃):
Mᵣ(NH₄NO₃) = (2 × 14) + (4 × 1) + (3 × 16) = 80
w(N) = (2 × 14 ÷ 80) × 100% ≈ 35.0%
Правильный порядок:
Натриевая селитра (NaNO₃) ≈ 16.5%
Кальциевая селитра (Ca(NO₃)₂) ≈ 17.1%
Аммиачная селитра (NH₄NO₃) ≈ 35.0%
Стр. 42
Используйте дополнительную информацию
11. Подготовьте сообщение по теме «Из истории измерения атомных масс химических элементов».
Сообщение
Из истории измерения атомных масс химических элементов
Проблема измерения атомных масс химических элементов занимает важное место в развитии химии и физики. Современные представления о массе атомов основываются на длительных исследованиях, начавшихся еще в XVIII–XIX веках. В разные периоды ученые предлагали различные методы определения массы атомов, что привело к созданию единой системы измерений и принятию относительной атомной массы как основной характеристики элементов.
1. Первые представления об атомной массе
Еще в древности философы задумывались о том, из чего состоит материя. Демокрит выдвинул гипотезу, что все вещества состоят из мельчайших неделимых частиц — атомов. Однако численные измерения массы атомов стали возможны только после развития химии как науки. В XVIII веке Антуан Лавуазье сформулировал закон сохранения массы, который стал основой количественного подхода к химическим процессам.
2. Открытие атомных масс и работы Джона Дальтона
Первые попытки определить массы атомов предпринимал английский ученый Джон Дальтон. В начале XIX века он разработал первую атомно-молекулярную теорию, в которой предположил, что атомы различных элементов имеют разную массу. Дальтон предложил первую таблицу относительных атомных масс, приняв водород за единицу измерения. Однако его метод был несовершенен, так как он не учитывал сложность химических соединений и существование изотопов.
3. Развитие метода измерения атомных масс
В середине XIX века итальянский химик Станислао Канниццаро уточнил метод измерения атомных масс, предложив использовать закон Авогадро. Согласно этому закону, равные объемы газов при одинаковых условиях содержат одинаковое число молекул. Это позволило точнее определять атомные массы элементов, сравнивая массы их молекул.
Важным этапом стало создание периодической таблицы Дмитрием Менделеевым в 1869 году. Он расположил элементы в порядке возрастания атомной массы и заметил, что химические свойства элементов повторяются через определенные интервалы. Менделеев также предсказал существование неизвестных элементов и их атомные массы, что позже подтвердилось экспериментально.
4. Развитие спектроскопии и открытие изотопов
В конце XIX — начале XX века развитие спектроскопии и масс-спектрометрии позволило более точно измерять массы атомов. Британский физик Джозеф Томсон в 1913 году открыл изотопы — разновидности атомов одного элемента с разной массой. Это объяснило расхождения в ранних таблицах атомных масс и позволило уточнить их значения.
Фрэнсис Астон, ученик Томсона, разработал первый масс-спектрометр, который позволил определять относительные массы атомов с высокой точностью. Он также ввел понятие "относительная атомная масса", используя в качестве эталона изотоп кислорода.
5. Современные методы измерения атомных масс
В настоящее время атомные массы определяются с высокой точностью с помощью масс-спектрометрии. В 1961 году был принят международный стандарт: за единицу относительной атомной массы приняли 1/12 массы атома углерода-12 (12C). Это позволило создать точные таблицы атомных масс для всех химических элементов.
Современные ученые продолжают исследования, связанные с измерением массы атомов, особенно в области сверхтяжелых элементов. Новые технологии, такие как ионные ловушки и лазерная спектроскопия, позволяют достигать предельной точности в определении атомных масс.
Заключение
Измерение атомных масс — важный процесс, который сыграл ключевую роль в развитии химии и физики. Благодаря многовековым исследованиям ученые смогли создать точную систему измерения, основанную на стандартизированных значениях. Сегодня атомные массы химических элементов являются фундаментальной характеристикой веществ, используемой в самых различных областях науки и техники.







