Решебник по химии 8 класс Габриелян §10
§10
Химические уравнения
Стр. 50
Вопрос
Если символы химических элементов — это буквы «химического алфавита», а химические формулы — «химические слова», что выступает в роли «химических предложений»?
В роли «химических предложений» выступают химические уравнения, которые записывают с помощью химических формул и математических знаков. Подобно тому, как слова соединяются в осмысленные фразы, химические формулы соединяются в уравнения, выражая процесс химического превращения веществ. Химическое уравнение показывает, какие вещества вступают в реакцию (реагенты) и какие вещества образуются в результате (продукты реакции). Например, уравнение 2H₂ + O₂ → 2H₂O описывает процесс соединения водорода и кислорода с образованием воды. Химические уравнения подчиняются строгим законам, главным из которых является закон сохранения массы веществ, требующий, чтобы число атомов каждого элемента до и после реакции оставалось неизменным. Таким образом, химические уравнения играют ключевую роль в описании химических процессов, делая их понятными и количественно точными.
Стр. 52
Лабораторный опыт 8
Что наблюдается при добавлении фенолфталеина в раствор едкого натра (NaOH)?
При добавлении 1–2 капель фенолфталеина в раствор NaOH раствор приобретает ярко-малиновый цвет. Это связано с тем, что фенолфталеин является кислотно-основным индикатором: в щелочной среде он окрашивается в малиновый цвет, а в кислой среде становится бесцветным.
Что происходит при добавлении раствора серной кислоты (H₂SO₄) в раствор NaOH?
При добавлении раствора H₂SO₄ в раствор NaOH происходит нейтрализация – реакция между кислотой и щелочью, приводящая к образованию соли и воды. По мере добавления кислоты окраска раствора исчезает, так как фенолфталеин становится бесцветным в нейтральной среде.
Какой вывод можно сделать из показаний электронных весов до и после реакции?
Показания весов до реакции и после реакции остаются неизменными. Это подтверждает закон сохранения массы веществ, согласно которому масса реагентов равна массе продуктов реакции. В ходе нейтрализации образуется сульфат натрия (Na₂SO₄) и вода (H₂O), но суммарная масса веществ остаётся неизменной.
Запишите схему реакции нейтрализации между NaOH и H₂SO₄.
Схема реакции нейтрализации:
Щёлочь + Кислота → Соль + Вода
NaOH + H₂SO₄ → Na₂SO₄ + H₂O
При этом уравнение реакции с расставленными коэффициентами выглядит так:
2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O
Эта реакция является классическим примером кислотно-основного взаимодействия, при котором ионы H⁺ из кислоты соединяются с гидроксид-ионами OH⁻ из щёлочи, образуя молекулы воды.
Стр. 52
Лабораторный опыт 9
Что наблюдается при смешивании раствора сульфата железа (III) Fe₂(SO₄)₃ и раствора едкого натра NaOH?
При смешивании раствора Fe₂(SO₄)₃ с раствором NaOH образуется бурый осадок гидроксида железа (III) Fe(OH)₃. Это происходит потому, что ионы Fe³⁺ взаимодействуют с гидроксид-ионами OH⁻, образуя малорастворимое соединение Fe(OH)₃, которое выпадает в осадок. Раствор при этом мутнеет, и в нём образуются характерные хлопья бурого цвета.
Как изменяются показания весов до и после реакции?
Показания весов до и после реакции остаются неизменными, что подтверждает закон сохранения массы веществ. Несмотря на то, что в ходе реакции образуется нерастворимый осадок Fe(OH)₃, масса всех веществ в системе сохраняется, так как никакие вещества не покидают реакционную систему.
Запишите схему реакции между Fe₂(SO₄)₃ и NaOH.
Схема реакции:
Соль + Щёлочь → Другая соль + Нерастворимое основание (осадок)
Fe₂(SO₄)₃ + NaOH → Na₂SO₄ + Fe(OH)₃↓
Полное уравнение реакции с расставленными коэффициентами:
Fe₂(SO₄)₃ + 6NaOH → 3Na₂SO₄ + 2Fe(OH)₃↓
В результате реакции образуется сульфат натрия (Na₂SO₄), который остаётся в растворе, и гидроксид железа (III) Fe(OH)₃, который выпадает в осадок (↓). Это типичная реакция обмена, где два вещества обмениваются своими ионами.
Стр. 52
Проверьте свои знания
1. Что представляет собой химическое уравнение? Какому основному закону химии оно должно соответствовать?
Химическое уравнение – это условная запись химической реакции с помощью химических формул и математических знаков. В уравнении записывают исходные вещества (реагенты) и продукты реакции, а между ними ставят стрелку, показывающую направление процесса. Запись химического уравнения должна соответствовать закону сохранения массы веществ, открытому Михаилом Ломоносовым и Антуаном Лавуазье. Согласно этому закону, масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Это означает, что число атомов каждого химического элемента в левой и правой частях уравнения должно быть одинаковым. Для этого используются коэффициенты, уравнивающие число атомов элементов. Если уравнение составлено правильно, оно отражает количественное соотношение между веществами, участвующими в химической реакции.
2. Какой процесс происходит при взаимодействии фосфора и кислорода? Запишите реакцию между этими веществами.
При взаимодействии фосфора (P) и кислорода (O₂) происходит процесс горения, который является экзотермической реакцией (идёт с выделением тепла и света). В результате образуется фосфорный ангидрид (P₂O₅), который является оксидом фосфора. Этот процесс можно записать в виде химического уравнения:
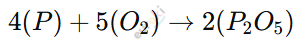
Фосфор сначала соединяется с кислородом, образуя оксид, а затем этот оксид может взаимодействовать с водой, образуя фосфорную кислоту (H₃PO₄). Таким образом, продукт реакции (P₂O₅) является кислотным оксидом, способным вступать в дальнейшие химические взаимодействия.
3. Какую информацию несёт химическое уравнение химической реакции?
Химическое уравнение содержит важную информацию о реакции и её участниках. Оно показывает качественный состав реагентов и продуктов, то есть какие вещества вступают в реакцию и что образуется в результате. Также уравнение отражает количественные соотношения между частицами, позволяя определить число атомов, молекул и моль веществ, участвующих в процессе. Кроме того, химическое уравнение указывает на тип реакции – например, горение, разложение, соединение или замещение. В некоторых случаях в уравнении могут быть обозначены условия реакции (температура, катализаторы, давление). Если уравнение составлено с использованием коэффициентов, оно полностью соответствует закону сохранения массы веществ, что позволяет проводить расчёты по уравнению реакции, предсказывать выход продуктов и определять их массы.
Стр. 53
Примените свои знания
4. Составьте уравнения химических реакций по описанию: а) при взаимодействии оксида железа (III) Fe₂O₃ с водородом образуется железо и вода; б) хлор Cl₂ взаимодействует с алюминием с образованием хлорида алюминия AlCl₃; в) реакция между натрием и азотом N₂ приводит к образованию нитрида натрия Na₃N.
а) Взаимодействие оксида железа (III) с водородом – это реакция восстановления:
Fe₂O₃ + 3H₂ → 2Fe + 3H₂O
б) Взаимодействие хлора с алюминием – это реакция соединения с образованием хлорида алюминия:
2Al + 3Cl₂ → 2AlCl₃
в) Реакция натрия с азотом приводит к образованию нитрида натрия:
6Na + N₂ → 2Na₃N
Во всех этих уравнениях расставлены коэффициенты, обеспечивающие сохранение массы веществ, согласно закону сохранения массы.
5. Расставьте коэффициенты в схемах реакций: а) Al + S → Al₂S₃; б) K + H₂O → KOH + H₂↑; в) AgNO₃ + CaCl₂ → AgCl↓ + Ca(NO₃)₂; г) Al₂(SO₄)₃ + KOH → Al(OH)₃↓ + K₂SO₄.
а) В уравнении Al + S → Al₂S₃ алюминий и сера образуют сульфид алюминия. Для уравнивания количества атомов алюминия и серы ставим коэффициенты:
2Al + 3S → Al₂S₃
б) В уравнении K + H₂O → KOH + H₂↑ калий реагирует с водой, образуя гидроксид калия и выделяя водород. Учитываем количество атомов:
2K + 2H₂O → 2KOH + H₂↑
в) В уравнении AgNO₃ + CaCl₂ → AgCl↓ + Ca(NO₃)₂ ионы серебра обмениваются с ионами кальция, образуя осадок хлорида серебра. Для уравнивания ставим коэффициенты:
2AgNO₃ + CaCl₂ → 2AgCl↓ + Ca(NO₃)₂
г) В уравнении Al₂(SO₄)₃ + KOH → Al(OH)₃↓ + K₂SO₄ алюминий взаимодействует с гидроксидом калия, образуя осадок гидроксида алюминия. Расставляем коэффициенты:
Al₂(SO₄)₃ + 6KOH → 2Al(OH)₃↓ + 3K₂SO₄
Все уравнения теперь соблюдают закон сохранения массы веществ, и количество атомов каждого элемента одинаково в левой и правой части.
6. Расставьте коэффициенты в схеме реакции: Al₂(SO₄)₃ + NaOH → Na₂SO₄ + Al(OH)₃↓ и перечислите информацию, которую несёт данное химическое уравнение.
Для уравнивания количества атомов в правой и левой частях уравнения расставляем коэффициенты:
Al₂(SO₄)₃ + 6NaOH → 3Na₂SO₄ + 2Al(OH)₃↓
Данное уравнение содержит следующую информацию:
Качественный состав: в реакции участвуют сульфат алюминия (Al₂(SO₄)₃) и гидроксид натрия (NaOH), а в продуктах образуются сульфат натрия (Na₂SO₄) и гидроксид алюминия (Al(OH)₃).
Количественные соотношения: две молекулы Al₂(SO₄)₃ реагируют с шестью молекулами NaOH, образуя три молекулы Na₂SO₄ и две молекулы Al(OH)₃.
Тип реакции: это реакция обмена, так как происходит обмен ионов между реагентами.
Образование осадка: Al(OH)₃↓ выпадает в осадок, что является важным признаком реакции.
Соблюдение закона сохранения массы: число атомов каждого элемента одинаково в левой и правой частях уравнения.
Таким образом, химическое уравнение позволяет не только представить химический процесс, но и провести расчёты количественного соотношения веществ.
7. Расставьте коэффициенты в схемах химических реакций. Укажите два уравнения, сумма коэффициентов в которых одинакова: а) Al(OH)₃ + HCl → AlCl₃ + H₂O; б) Fe₂O₃ + Al → Al₂O₃ + Fe; в) Mg + HBr → MgBr₂ + H₂↑; г) Fe(OH)₃ → Fe₂O₃ + H₂O.
Расставляем коэффициенты:
а) Al(OH)₃ + 3HCl → AlCl₃ + 3H₂O
Сумма коэффициентов: 1 + 3 + 1 + 3 = 8
б) Fe₂O₃ + 2Al → Al₂O₃ + 2Fe
Сумма коэффициентов: 1 + 2 + 1 + 2 = 6
в) Mg + 2HBr → MgBr₂ + H₂↑
Сумма коэффициентов: 1 + 2 + 1 + 1 = 5
г) 2Fe(OH)₃ → Fe₂O₃ + 3H₂O
Сумма коэффициентов: 2 + 1 + 3 = 6
Два уравнения с одинаковой суммой коэффициентов:
Реакция Fe₂O₃ + Al → Al₂O₃ + Fe (6)
Разложение Fe(OH)₃ → Fe₂O₃ + H₂O (6)
Эти уравнения имеют одинаковую сумму коэффициентов и подтверждают закон сохранения массы веществ.
8. Выберите схемы реакций, в которых нужно расставить коэффициенты. Составьте уравнения этих реакций: а) H₂ + Br₂ → HBr б) Fe(OH)₂ → FeO + H₂O в) CO + O₂ → CO₂↑ г) P + Cl₂ → PCl₃.
Расставляем коэффициенты:
а) Взаимодействие водорода с бромом:
H₂ + Br₂ → 2HBr
(Коэффициент 2 перед HBr уравнивает количество атомов брома.)
б) Разложение гидроксида железа (II):
Fe(OH)₂ → FeO + H₂O
(Все коэффициенты равны 1, так как уравнение уже сбалансировано.)
в) Горение угарного газа (CO):
2CO + O₂ → 2CO₂↑
(Коэффициент 2 перед CO₂ уравнивает количество атомов углерода и кислорода.)
г) Реакция фосфора с хлором:
2P + 3Cl₂ → 2PCl₃
(Коэффициенты 2 и 3 обеспечивают равенство атомов фосфора и хлора.)
Вывод:
Все схемы реакций требуют расстановки коэффициентов, чтобы соблюдать закон сохранения массы веществ. После уравнивания количество атомов каждого элемента остается одинаковым в левой и правой частях уравнения.
9. Как соотносятся коэффициенты перед формулами продуктов реакции между растворами сульфата железа (III) и едкого натра?
Рассмотрим уравнение реакции между сульфатом железа (III) Fe₂(SO₄)₃ и едким натром NaOH. В результате реакции образуется сульфат натрия Na₂SO₄ и гидроксид железа (III) Fe(OH)₃↓, который выпадает в осадок.
Записываем уравнение реакции с расставленными коэффициентами:
Fe₂(SO₄)₃ + 6NaOH → 3Na₂SO₄ + 2Fe(OH)₃↓
Таким образом, коэффициенты перед продуктами реакции соотносятся как 3:2, где:
3 – перед Na₂SO₄,
2 – перед Fe(OH)₃↓.
Это означает, что на три молекулы сульфата натрия приходится две молекулы гидроксида железа (III), что соответствует закону сохранения массы веществ.
10. Расставьте коэффициенты в схемах химических реакций. В каких уравнениях сумма коэффициентов перед формулами исходных веществ равна 3? а) NaOH + H₂SO₄ → Na₂SO₄ + H₂O; б) K₂SO₄ + BaCl₂ → KCl + BaSO₄↓; в) Al + HCl → AlCl₃ + H₂; г) CuSO₄ + KOH → Cu(OH)₂↓ + K₂SO₄.
Расставляем коэффициенты:
а) Нейтрализация гидроксида натрия серной кислотой:
2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O
Сумма коэффициентов перед исходными веществами: 2 + 1 = 3 ✅
б) Обменная реакция сульфата калия и хлорида бария:
K₂SO₄ + BaCl₂ → 2KCl + BaSO₄↓
Сумма коэффициентов перед исходными веществами: 1 + 1 = 2 ❌
в) Взаимодействие алюминия с соляной кислотой:
2Al + 6HCl → 2AlCl₃ + 3H₂
Сумма коэффициентов перед исходными веществами: 2 + 6 = 8 ❌
г) Осаждение гидроксида меди (II) из сульфата меди (II):
CuSO₄ + 2KOH → Cu(OH)₂↓ + K₂SO₄
Сумма коэффициентов перед исходными веществами: 1 + 2 = 3 ✅
Вывод
Сумма коэффициентов перед формулами исходных веществ равна 3 в уравнениях:
2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O
CuSO₄ + 2KOH → Cu(OH)₂↓ + K₂SO₄
Стр. 53
Используйте дополнительную информацию
11. В 1673 г. один из выдающихся английских учёных нагрел на воздухе при высокой температуре некоторые металлы и после их охлаждения обнаружил, что масса металлов увеличилась. Кто этот учёный? Как бы вы предложили изменить условия опыта, чтобы доказать справедливость закона сохранения массы?
Учёным, который провёл этот эксперимент, был Роберт Бойль. Он заметил, что после нагревания металлы увеличивают свою массу. Это наблюдение позже было объяснено тем, что металл вступает в реакцию с кислородом воздуха, образуя оксиды металлов. Например:
2Mg + O₂ → 2MgO
В этом процессе к металлу присоединяется кислород, увеличивая общую массу.
Чтобы доказать закон сохранения массы, можно провести модифицированный эксперимент:
Нагревать металл в закрытой системе, например, в герметично закрытом сосуде, где невозможно ни прибавление, ни потеря вещества.
Использовать чувствительные весы и взвешивать всю систему (металл + сосуд + воздух внутри) до и после нагревания.
Нагреть металл в атмосфере инертного газа (например, азота), чтобы предотвратить взаимодействие с кислородом. Если масса металла остаётся неизменной, это подтвердит, что прирост массы в предыдущем опыте был вызван присоединением кислорода.
Таким образом, этот опыт показывает важность учёта всех веществ, участвующих в реакции, и подтверждает закон сохранения массы веществ, открытый позже Антуаном Лавуазье.
12. Подготовьте сообщение о развитии «химической письменности».
Сообщение
Развитие «химической письменности»
Химическая письменность – это система обозначений химических элементов, соединений и реакций, позволяющая компактно и точно передавать информацию о составе и свойствах веществ. Она прошла долгий путь развития от примитивных символов древних алхимиков до современной международной системы химической нотации.
1. Алхимические символы
В древности химические элементы и соединения обозначались с помощью сложных графических символов, напоминающих магические знаки. Эти обозначения использовали средневековые алхимики, пытаясь зашифровать свои знания. Например, золото обозначалось знаком ☉ (символ Солнца), серебро – ☽ (символ Луны), а ртуть – ☿ (символ Меркурия).
2. Введение систематических обозначений
Настоящий прорыв в химической письменности произошёл в конце XVIII – начале XIX века, когда Антуан Лавуазье и его последователи предложили использовать буквенные обозначения элементов на основе их латинских названий. В 1813 году шведский химик Йёнс Якоб Берцелиус разработал систему, в которой каждому химическому элементу присваивалась первая буква его латинского названия (например, кислород – O, водород – H). Если названия элементов начинались на одну и ту же букву, добавлялась вторая буква (магний – Mg, марганец – Mn).
3. Современная система химических формул
Система Берцелиуса легла в основу современной химической нотации. В ней используется индексы, указывающие количество атомов в молекуле (например, вода – H₂O, углекислый газ – CO₂). Также появились коэффициенты, обозначающие количество молекул в уравнениях реакций (например, 2H₂ + O₂ → 2H₂O).
4. Химические уравнения и их роль
Со временем химическая письменность стала не только способом обозначения веществ, но и инструментом для записи химических реакций. Химические уравнения позволяют не только записывать процесс взаимодействия веществ, но и демонстрировать соблюдение закона сохранения массы (например, реакция горения водорода: 2H₂ + O₂ → 2H₂O).
5. Развитие компьютерной химической нотации
В XX–XXI веках химическая письменность адаптировалась для цифрового представления. Были разработаны специальные форматы для записи молекул, такие как SMILES (Simplified Molecular Input Line Entry System) и InChI (International Chemical Identifier), которые позволяют компьютерам «читать» и анализировать химические структуры.
Вывод
Развитие химической письменности сделало химию точной наукой, позволив учёным записывать сложные реакции, обмениваться знаниями и разрабатывать новые вещества. Сегодня химическая нотация является универсальным языком, который понимают химики всего мира, обеспечивая международное сотрудничество и развитие науки.







